Cell:为什么肝脏等器官衰老得更快?非编码DNA中隐藏的突变是关键
来源:生物世界 2024-09-23 10:22
在长期处于休眠状态的细胞中,非编码区积累了太多的隐匿性的DNA损伤,这些区域包含复制起始位点,从而阻止了DNA复制的启动。
日内瓦大学、伯尔尼大学的研究人员在国际顶尖学术期刊 Cell 上发表了题为:In vivo DNA replication dynamics unveil aging-dependent replication stress(体内DNA复制动力学揭示了衰老依赖的复制应激)的研究论文。
该研究表明,非编码DNA的损伤往往被隐藏了,它们在增殖缓慢的组织中积累得更多(例如肝脏或肾脏)。与频繁再生的器官不同,这些增殖缓慢的器官中的非编码DNA损伤长期未被发现,进而阻碍了细胞分裂。这些发现解释了什么有些器官(例如肝脏)比其他器官衰老得更快,也为理解细胞衰老以及减缓衰老进程开辟了潜在新途径。

基因组中的DNA包含编码区(编码蛋白质的基因)和非编码区(参与调控或组织基因组)。它们都会不断受到外部和内部因素导致的损伤,而细胞有着DNA修复系统,以防止损伤的积累。
当基因被转录时,位于编码区的DNA损伤会被检测到。而位于非编码区的DNA损伤则在细胞更新时被检测到(也就是每次通过DNA复制过程创建新基因组副本时)。然而,不同组织或器官的细胞更新频率各不相同。
经常与外界环境接触的组织和器官,例如皮肤或肠道,其细胞更新的频率为每周1-2次,远高于肝脏和肾脏等内脏器官的每年几次,细胞更新时的DNA复制会检测到非编码DNA损伤并进行修复,因此,不同器官中的非编码DNA损伤被检测到和修复的可能性并不相同。
肝脏是研究衰老的理想模型,肝脏细胞的分裂频率较低,因此,其DNA复制频率也较低,在这项最新研究中,研究团队分析了肝脏衰老速度加快与其细胞DNA复制频率较低之间的潜在联系。
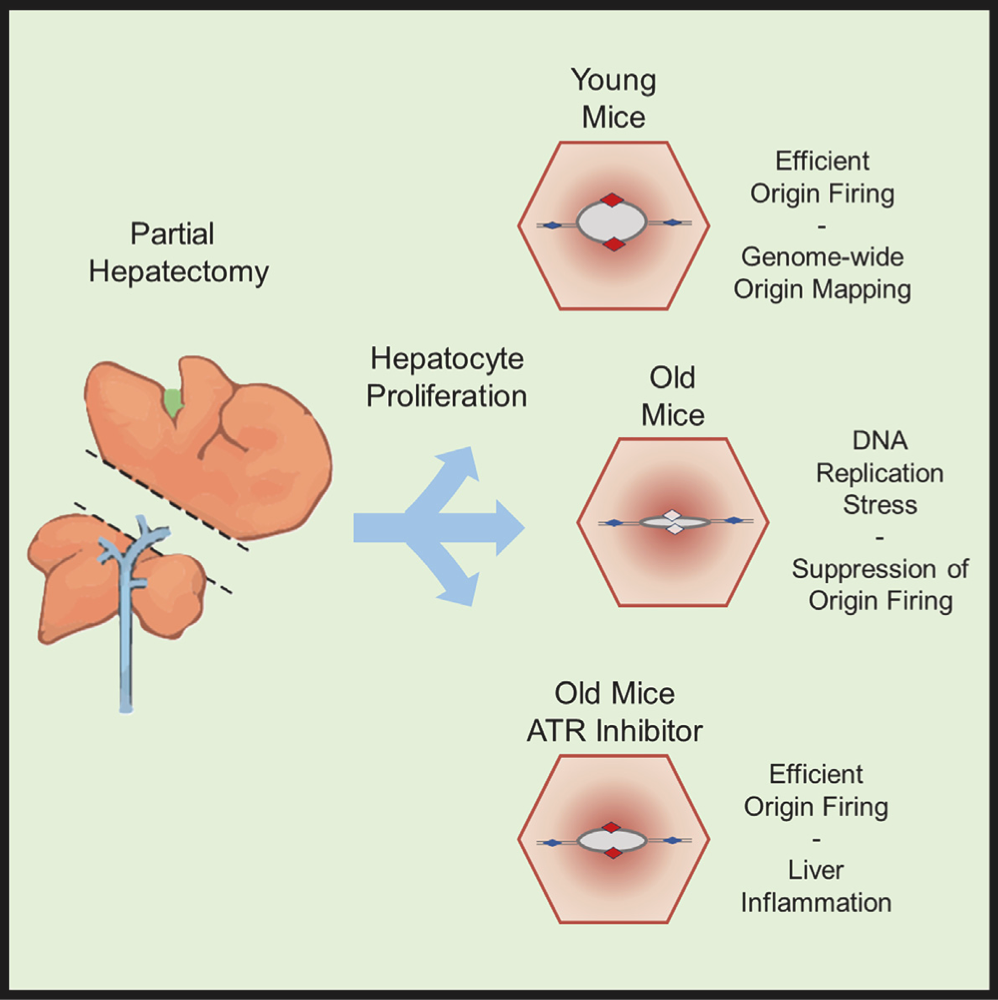
小鼠肝脏是研究体内DNA复制机制的理想器官。在成年哺乳动物中,除非肝脏被部分切除,否则肝细胞很少增殖。在切除年轻小鼠或年老小鼠的三分之二的肝脏后,就可以直接在活体动物中研究年轻或衰老器官的DNA复制机制。
通过首次绘制部分切除后再生的肝细胞中DNA复制起始点,该研究发现,在年轻小鼠中,DNA复制起始点定义明确, 大多数位于表达基因上游10-50kb或下游的非编码区,其在人类细胞中的位置是保守的。在老年小鼠中,也存在相同的DNA起复制始点,但起始效率低下,并伴有复制应激(Replication Stress,RS)反应。
ATR检查点是DNA损伤应答机制的核心组成部分,主要负责感知复制应并将其信号传导至S期和G2/M期检查点,以启动DNA修复。该研究显示,ATR检查点激酶抑制剂完全恢复了老年小鼠的DNA复制起始效率,但同时也伴随着炎症反应,且没有显著提高肝细胞进入细胞周期的百分比。这些发现揭示了年龄相关的复制应激,以及ATR检查点在缓解年龄相关炎症这一衰老标志物中的关键作用。
研究团队表示,这些DNA非编码区不受定期损伤检查的影响,因此随着时间的推移会累积损伤。在部分切除年轻小鼠的肝脏后,它们有着很小的DNA损伤,DNA复制是可能的。而在年老小鼠身上进行同样实验时,随着时间的推移,过多的DNA损伤累积会触发阻止DNA复制的警报系统。这种DNA复制的阻止,抑制了细胞增殖,导致细胞功能退化和组织衰老。
这些观察结果可能有助于解释为什么缓慢增殖的组织(例如肝脏)比快速增殖的组织(例如肠道)衰老得更快。

DNA损伤的肝细胞被染成红色(图左侧),没有DNA损伤的增殖的肠细胞被染成黄色(图右侧)
在长期处于休眠状态的细胞中,非编码区积累了太多的隐匿性的DNA损伤,这些区域包含复制起始位点,从而阻止了DNA复制的启动。另一方面,在快速增殖的组织中,由于频繁的细胞更新,很少有损伤积累,并且复制起始一直保持了高效性。
最后,研究团队表示,这项研究提示我们,在复制被触发之前修复隐匿性的DNA损伤,或许可以避免衰老,团队接下来的工作将聚焦于这个新方向。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


