Nature Genetics | 揭示帕金森病的幕后推手:RAB32基因新变异的发现
来源:网络 2024-06-15 15:59
该研究通过大规模的家族性帕金森病病例和对照组的外显子测序,发现了RAB32基因的新型高风险变异,这一发现为进一步研究帕金森病的致病机制提供了新的线索。
帕金森病(Parkinson's Disease,PD)是一种常见的神经退行性疾病,约10-15%的病例具有家族性(familial cases),即这些患者的直系亲属中也有人患有相同的疾病。尽管在家族性PD的致病变异识别方面取得了显著进展,但目前仅少数病例能够明确致病变异,大部分高风险致病变异仍未被发现。6月10日Nature Genetics的报道“Systematic rare variant analyses identify RAB32 as a susceptibility gene for familial Parkinson’s disease”,通过对2,184例家族性PD病例和69,775例对照的外显子测序数据进行统一处理,发现了RAB32基因的新型高风险变异c.213C>G/p.S71R,该变异在家族性PD病例中出现率为约0.7%,而在对照组中仅为0.004%。
RAB32基因编码一种小GTP酶,已知其与LRRK2(leucine-rich repeat kinase 2)相互作用。功能分析显示,RAB32 S71R变异增加了LRRK2的激酶活性,这通过增加LRRK2 S1292的自磷酸化得到验证。研究结果表明,RAB32变异在PD的关键病理机制——LRRK2激酶活性中起重要作用,从而为理解RAB家族生物学、LRRK2与PD风险之间的机制联系提供了新的见解。
目前,有七个基因被确定与家族性PD明确相关,这些基因的发现极大地促进了我们对PD的理解,最终催生了药物靶点、生物标志物以及对疾病机制的关键见解。然而,传统的家族研究方法(如连锁分析、纯合性筛选和分离过滤)在许多情况下由于家族间的遗传异质性、外显率降低和家族样本量有限等原因不足以识别致病变异。稀有变异关联测试方法(如基因负荷分析)提供了一种替代策略,通过病例对照差异在累积稀有变异频率中的差异来发现稀有遗传风险因素。
该研究采用了基因负荷分析(gene burden analysis)策略,限制分析对象为家族性PD病例和对照,从而增强了灵敏度。在对2,184例家族性PD病例和69,775例对照进行外显子测序和全基因组测序数据分析后,首次在家族性PD中发现了RAB32 p.S71R变异,并通过Sanger测序在所有病例中确认了该变异的存在。
该研究不仅揭示了RAB32变异在家族性PD中的作用,还强调了LRRK2激酶活性在PD病理机制中的重要性。未来的研究需要进一步探讨RAB32 S71R变异增加LRRK2活性的机制,特别是其是否通过类似于RAB29的四聚化作用来激活LRRK2。此外,这项研究也证明了家族性病例的采集和大量对照组结合使用在识别低频变异中的有效性,这对于PD以及其他复杂疾病的遗传研究具有重要意义。

帕金森病(Parkinson's Disease,PD)是一种常见的神经退行性疾病,影响了全球数百万人的生活质量。该病的症状包括震颤、运动迟缓和僵硬等,严重影响患者的日常生活能力。尽管帕金森病的确切病因尚不完全清楚,但已有研究表明其发病与遗传因素密切相关。约10-15%的帕金森病病例具有家族性(familial cases),即这些患者的直系亲属中也有人患有相同的疾病。家族性病例的研究有助于揭示帕金森病的致病机制,为疾病的预防和治疗提供新的方向。
研究团队收集了来自不同来源的2,184例家族性帕金森病(familial Parkinson's Disease,PD)病例和69,775例对照的外显子测序数据(exome sequencing data)。这些数据来源于多达16个队列,包括全外显子测序(Whole-Exome Sequencing,WES)和全基因组测序(Whole-Genome Sequencing,WGS)数据。所有样本均经过严格的质量控制,确保数据的准确性和可靠性。
所有收集到的外显子测序数据首先被对齐到人类基因组参考序列(Genome Reference Consortium human build 38,GRCh38)。使用Burrow-Wheeler对齐工具(Burrow-Wheeler Aligner,BWA-MEM)进行对齐,并通过GATK(Genome Analysis Toolkit)进行联合变异调用(joint variant calling)。为了确保数据的质量,研究团队排除了那些质量评分低于20的基因型调用(genotype calls),以及那些由非信息性读数支持的变异调用。
对通过质量控制的变异,使用snpEff和dbscSNV进行了功能注释。变异被分类为高影响(loss-of-function)变异,包括无义突变(nonsense mutations)、剪接受体/供体突变(splice acceptor/donor mutations)和移码突变(frameshift mutations)。此外,变异也被分类为中等影响(moderate impact)变异,包括错义突变(missense mutations)和框内缺失(inframe deletions)。
样本的遗传背景(ancestry)通过将所有样本投影到1000基因组计划(1000 Genomes Project)的参考祖先空间中进行估计。研究团队保留了主要为欧洲血统的个体,并排除了基因型调用率低于90%、异质性异常、性别不一致以及具有高变异数量的样本。此外,通过KING软件识别出与其他样本存在二级及以上亲缘关系的样本,这些样本也被排除。
单变异分析
对于每个变异,研究团队使用Firth's Logistic Regression模型测试了PD状态与次要等位基因计数之间的关联,调整了性别、前十个主成分和每个个体的稀有同义变异总数。所有测试均采用双侧检验,并使用Bonferroni校正方法进行多重比较校正。对于在单变异分析中识别出的显著变异,研究团队进行了进一步的验证,确保这些变异不是由技术偏差引起的。
基因负荷分析
为了识别与家族性PD相关的基因,研究团队进行了基因负荷分析(gene burden analysis),包括低频(次要等位基因频率<0.05)和超稀有(≤5个携带者)非同义变异。采用的统计测试包括负荷测试(burden test)、序列核关联测试(sequencing kernel association test,SKAT)和组合Cauchy关联变异测试(aggregated Cauchy association test,ACAT-V)。这些测试结合在一起,以提高对低频变异的检测能力。
条件分析
为了评估基因负荷分析中的基因关联是否由单变异分析中识别出的显著变异驱动,研究团队进行了条件分析(conditional analysis),排除了相关基因中的显著单变异。这一步骤帮助确认了RAB32基因的关联主要由p.S71R变异驱动。
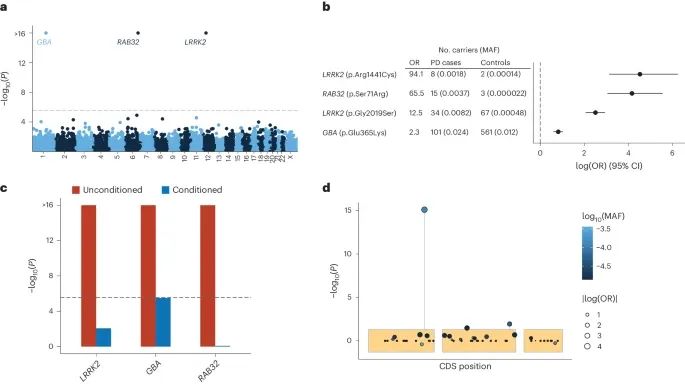
2,184例PD病例和69,775例对照中的稀有非同义基因和单变异分析结果。研究团队识别出了三个与帕金森病显著相关的基因:RAB32、LRRK2和GBA。这些基因中的稀有非同义变异在PD病例中的出现频率显著高于对照组,特别是RAB32的p.S71R变异,表明其可能在帕金森病的发病机制中起重要作用。(Credit: Nature Genetics)
功能验证
为了验证RAB32 p.S71R变异的功能影响,研究团队进行了以下实验:
细胞共转染实验
研究团队在HEK293细胞中进行共转染实验,将Myc标签的LRRK2野生型(wild type,WT)与HA标签的RAB32 WT或RAB32 S71R共同转染。通过Western blot分析,检测LRRK2 S1292的自磷酸化水平,这是一种已知的LRRK2激酶活性标志。
免疫共沉淀实验
为了评估RAB32与LRRK2之间的相互作用,研究团队进行了免疫共沉淀实验(coimmunoprecipitation)。结果显示,与RAB32 WT相比,RAB32 S71R变异显著增加了与LRRK2的相互作用。这一结果进一步支持了RAB32 S71R变异通过增加LRRK2激酶活性参与帕金森病的病理过程。
Sanger测序验证
为了验证在单变异分析中识别出的RAB32 p.S71R变异,研究团队对所有病例进行了Sanger测序。结果表明,所有病例均携带该变异,且在三大家族中,该变异与帕金森病共分离。

RAB32 S71R变异引发LRRK2激酶活性增加。RAB32 S71R变异通过增加LRRK2 S1292的自磷酸化和增强RAB32与LRRK2的相互作用,提高了LRRK2的激酶活性。这一发现揭示了RAB32 S71R变异在帕金森病病理机制中的重要作用,支持了RAB32变异可能通过调控LRRK2激酶活性参与帕金森病的发病过程。(Credit: Nature Genetics)
所以该研究显示,RAB32基因编码一种小GTP酶(small GTPase),已知其与LRRK2相互作用。LRRK2是一种已知与帕金森病相关的基因,许多致病变异会导致其激酶活性增加,从而引发一系列神经退行性变化。通过功能分析,研究团队发现RAB32 S71R变异显著增加了LRRK2的激酶活性,这通过增加LRRK2 S1292的自磷酸化水平得到验证。此外,RAB32 S71R变异还增加了RAB32与LRRK2的相互作用,这可能是导致激酶活性增加的原因。
这一发现为理解RAB家族生物学(RAB family biology)、LRRK2与帕金森病风险之间的机制联系提供了新的见解。该研究不仅揭示了RAB32变异在家族性帕金森病中的作用,还强调了LRRK2激酶活性在帕金森病病理机制中的重要性。
帕金森病是一种复杂的神经退行性疾病,涉及多种基因和环境因素的相互作用。尽管已有多个基因被确认与帕金森病相关,但仍有许多致病变异未被发现。该研究通过大规模的家族性帕金森病病例和对照组的外显子测序,发现了RAB32基因的新型高风险变异,这一发现为进一步研究帕金森病的致病机制提供了新的线索。
此外,研究结果表明RAB32变异通过增加LRRK2激酶活性,参与帕金森病的病理过程。这一发现不仅加深了我们对帕金森病分子机制的理解,还为开发新的治疗策略提供了理论基础。例如,靶向LRRK2激酶活性的药物可能成为治疗帕金森病的新途径。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


