《自然·免疫学》:反转了!迟洪波团队发现,CD8阳性T细胞或可限制阿尔茨海默病的进展
来源:奇点糕 2023-09-11 11:03
总之,T细胞在神经系统疾病中的作用日益受到人们关注,但目前许多研究成果都是相互矛盾的。因此,还是期盼科学家们未来能够描绘出,不同免疫细胞类型及其亚型在AD发生和进展过程中的作用,为AD等神经系统疾病提
一篇发表在《自然·免疫》期刊上的文章提出,T细胞确实在AD病理中与小胶质细胞有密谋,但它们是我们的友军。
美国圣裘德儿童研究医院迟洪波团队发现,小胶质细胞通过CXCL16–CXCR6信号通路,招募一群具有免疫抑制性的CD8+T细胞并维持其存活。这些CD8+T细胞通过抑制小胶质细胞介导的炎症反应,缓解AD病理及症状。

论文首页截图
首先,迟洪波团队对小鼠大脑免疫细胞进行单细胞RNA测序(scRNA-seq)。
分析结果显示,相比于野生型小鼠,AD小鼠模型(5xFAD)大脑浸润CD8+T细胞水平更高,CD4+T细胞、γδ T细胞等其它T细胞亚群的数量没有明显差异。AD小鼠大脑中的CD8+T细胞数量随年龄增长而积累,与β淀粉样蛋白斑块的形成同步。这些结果与之前在AD患者大脑样本中的发现一致。
借助遗传学手段使小鼠缺失不同T细胞亚群,他们发现,CD8+T细胞缺陷导致AD小鼠的β淀粉样蛋白斑块负荷增加,认知水平下降。换句话来说,CD8+T细胞能够帮助小鼠免受AD相关的病理影响。
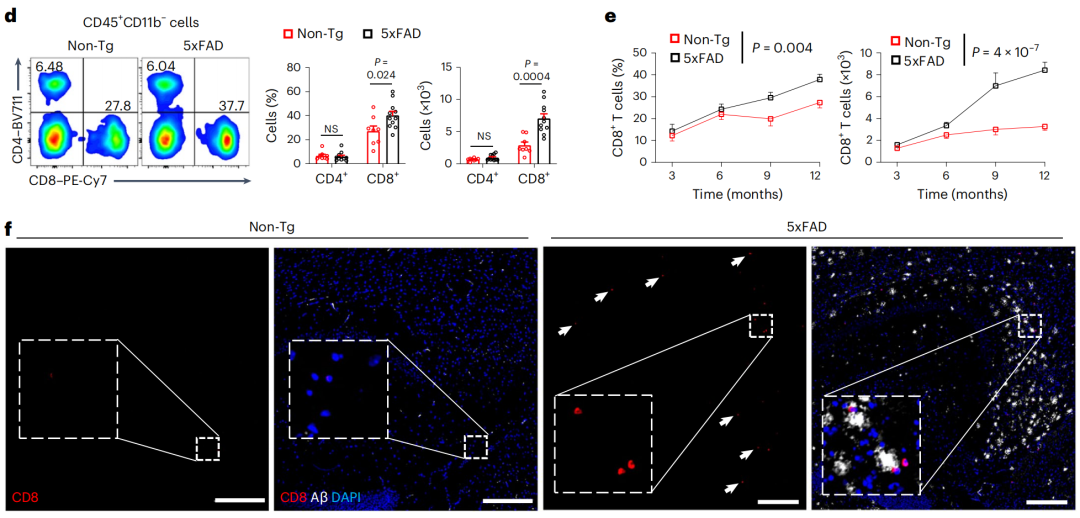
小鼠实验证明T细胞大脑浸润与AD病理相关
于是,研究者们对CD8+T细胞的“保护者”身份展开调查。
AD小鼠实验结果显示,CD8+T细胞进入大脑后,通过CXCL16–CXCR6信号通路与小胶质细胞发生相互作用和通信。其中,疾病相关的小胶质细胞高表达趋化因子CXCL16,CD8+T细胞以组织特异性的方式高表达趋化因子受体CXCR6。
结合AD患者的大脑样本以及体外实验,研究者们发现,CXCL16–CXCR6信号通路是小胶质细胞向T细胞打出的救援电话。
具体来看,在AD病理条件下,疾病相关的小胶质细胞聚集在β淀粉样蛋白斑块附近,并通过表达CXCL16将表达CXCR6的CD8+T细胞招募过来。
这些CD8+T细胞上的CD73、LAG3、CD39、TIGIT等免疫抑制标志物表达增加,在β淀粉样蛋白斑块附近落位后,抑制小胶质细胞产生促炎因子,从而限制AD病理中由小胶质细胞介导的炎症反应。
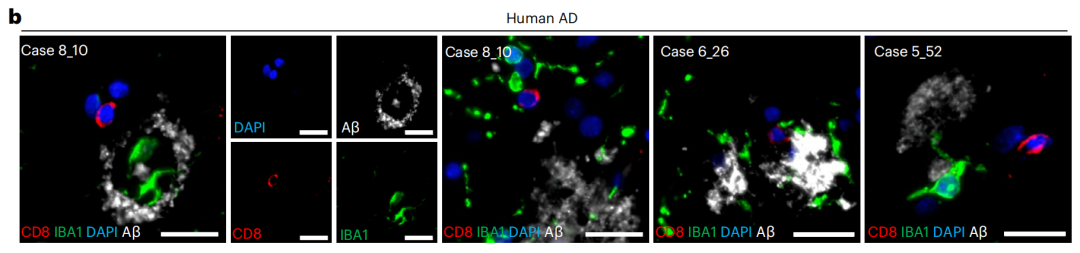
AD患者大脑样本中,T细胞与小胶质细胞共定位
不仅如此, CXCL16–CXCR6信号通路还是给CD8+T细胞发的一张大脑 “绿卡”,对于CD8+T细胞在大脑中的稳定存活和积累至关重要。CXCL16–CXCR6信号通路能够诱导进入大脑的CD8+T细胞重编程为组织驻留记忆T细胞,以高表达PD-1为特征。
当AD小鼠表达缺失CXCR6时,大脑浸润T细胞的增殖状态并无异常,但死亡数量大大增加,总体表现为水平下降;肺部、肝脏、脾脏中的T细胞水平基本没有影响。
从AD病理和症状来看,CXCR6表达缺失时,AD小鼠的β淀粉样蛋白斑块数量增加、小胶质细胞介导的炎症状态加剧,认知、记忆功能受损情况加重。
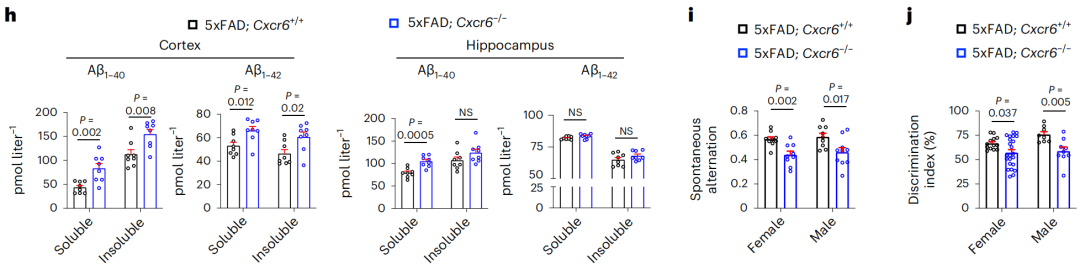
CXCR6表达缺失时的AD病理和症状受影响
总之,T细胞在神经系统疾病中的作用日益受到人们关注,但目前许多研究成果都是相互矛盾的。因此,还是期盼科学家们未来能够描绘出,不同免疫细胞类型及其亚型在AD发生和进展过程中的作用,为AD等神经系统疾病提供新的治疗方向。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


