《自然·医学》:一次液体活检,“算准”免疫治疗!ctDNA检测可超前并精准预测肺癌免疫治疗效果
来源:奇点糕 2023-04-10 10:45
研究者们使用验证集以及其它临床研究来源数据(OAK研究),评估了C3D1-ctDNA分析模型的区分准确度,发现高危患者的死亡风险远高于低危患者(HR=3.28),中位OS也分别为7.3个月和25.2个
为了让免疫治疗越用越精准,精准找到适合的患者群体,近几年科学家和医生们可以说绞尽脑汁,尝试了各种各样的新技术和新检测。但“让免疫治疗更精准”其实还该有另一层含义,那就是及早中止很可能无法见效的用药。
毕竟免疫治疗不是万能的,如果患者难以达到客观缓解,实现临床获益和长生存就比较困难,应及时调整为其它治疗方案,但这对检测和评估也提出了比较高的要求。如果能在治疗开始不久就实现准确预测,调整方案才有余地。
近期,一项发表在《自然·医学》上的最新研究,为这种设想提供了可能的手段:基于来自晚期非小细胞肺癌(NSCLC)免疫治疗临床III期IMpower150研究的数据,研究发现在治疗第3个周期第1天,使用液体活检方法检测ctDNA,可精准预测患者的总生存期(OS),从而指导后续的临床治疗。
该研究构建了机器学习模型,对不同时间节点上的ctDNA检测结果进行纵向分析,显示治疗第3个周期第1天的ctDNA水平越高,患者的中位OS就越短,高危患者的中位OS仅为低危患者的1/3,且该结论得到了其它研究数据的独立验证,这也是首个基于临床III期研究,纵向评估NSCLC患者ctDNA改变的分析[1-2]。

论文首页截图
基于ctDNA的液体活检,既往在NSCLC中更多是用于早期可手术患者,在术后检测可能提示复发的分子残留病灶(MRD),而本次分析中把ctDNA检测用到晚期转移性患者身上,则是因为当前基于影像学肿瘤体积变化(根据RECIST标准)评估免疫治疗应答仍有缺陷,至少不能满足早期预测疗效的需求。
而在EGFR等驱动基因阳性NSCLC中,ctDNA动态变化已被证实与靶向治疗的效果有关,免疫治疗当然可以借鉴这种做法。由基因泰克(Genentech)团队主导的研究者们,对IMpower150研究纳入的1200余例患者进行筛选,最终筛选出466例患者用于分析,分别构建训练队列(n=240)和验证集(n=226)。
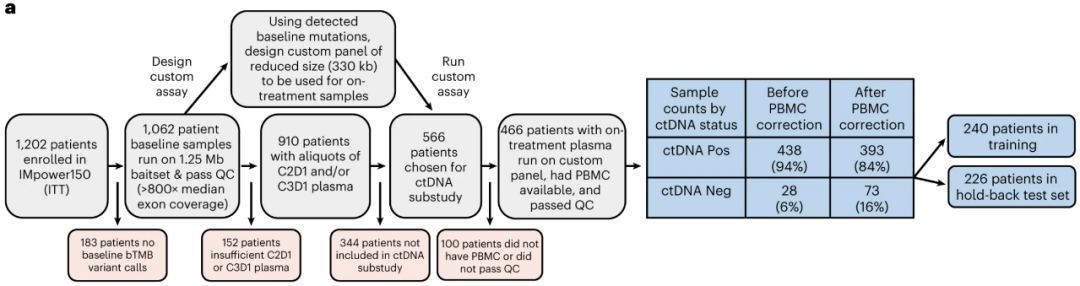
研究流程图
研究者们构建的ctDNA检测Panel共纳入311个基因,可在训练队列85%患者基线时的血液样本中检测到ctDNA。初步分析显示,患者在基线时的ctDNA水平,就与接受免疫联合治疗(阿替利珠单抗+贝伐珠单抗+含铂双药化疗,即ABCP四药联合方案)或含铂化疗后的中位OS有关,ctDNA水平越高、中位OS越短。
为更进一步实现早期预测疗效的目标,研究又分别对治疗第2、3、4、8个周期第1天(C2D1/C3D1/C4D1/C8D1)时的ctDNA水平进行分析,并结合治疗第6周时的影像学评估结果,分析它们与患者预后的关系。
数据显示,即使影像学评估的治疗应答同为部分缓解(PR)或疾病稳定(SD),根据C3D1时的ctDNA水平,也能将患者分为存在OS、PFS显著差异的高危/低危人群。研究者们因此选择C3D1作为后续研究的ctDNA时间点,利用机器学习模型分析C3D1时患者ctDNA特征,结合临床特征构建了更精准的分析模型。
新的C3D1-ctDNA分析模型将训练队列患者分为低危(实现分子层面应答,占训练集32%)、中危(分子层面SD,占40%)和高危(分子层面疾病进展,占28%)三类,患者中位OS则分别是31.2个月、18.8个月和9.5个月,差异明显。
最终,研究者们使用验证集以及其它临床研究来源数据(OAK研究),评估了C3D1-ctDNA分析模型的区分准确度,发现高危患者的死亡风险远高于低危患者(HR=3.28),中位OS也分别为7.3个月和25.2个月;对第6周时影像学评估应答为PR/SD的患者,C3D1-ctDNA分析模型也能分别准确找到低危和高危患者。
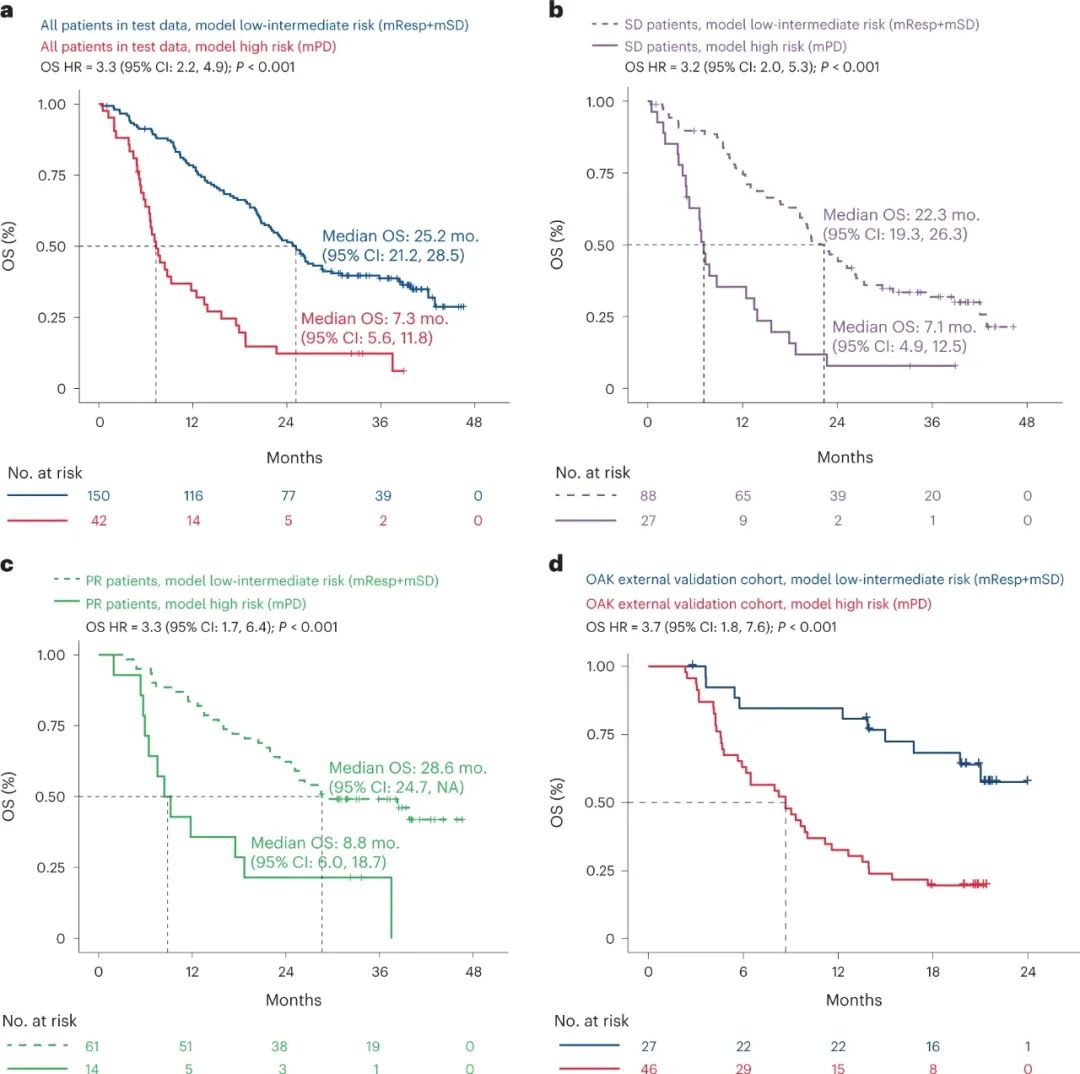
患者OS差异情况
而C3D1-ctDNA分析模型的应用,可能还不止于评估患者预后:研究者们进行的模拟分析显示,既然模型评估的分子层面应答(即低危患者),比影像学评估的PR更为精准,就可以作为临床早期研究的替代终点,作为用于药品审核上市的疗效指标,这还符合近年来许多抗肿瘤新药以早期研究数据加速上市的趋势。
当然了,要想让C3D1-ctDNA模型融入到临床实践的患者管理中,科学家和医生们还要付出很多努力,但能在免疫治疗第3个周期刚开始就做出准确预测,这种检测的水平还是非常值得称赞的,期待它尽快在临床发光发热~
参考文献:
[1]Assaf Z J F, Zou W, Fine A D, et al. A longitudinal circulating tumor DNA-based model associated with survival in metastatic non-small-cell lung cancer[J]. Nature Medicine, 2023.
[2]https://www.genomeweb.com/sequencing/advanced-cancer-outcomes-predicted-using-model-based-circulating-tumor-dna-metrics
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


