许晓阳/章雪晴团队开发mRNA-LNP介导的细胞焦亡疗法,增强肿瘤免疫治疗效果
来源:生物世界 2023-09-05 09:35
在多个免疫冷肿瘤小鼠模型中,研究结果表明,mRNA-LNP触发的细胞焦亡可以抑制肿瘤生长和延长小鼠模型总生存期,并伴有促炎细胞因子的刺激和促进肿瘤微环境中免疫细胞的募集。
近日,上海交通大学章雪晴教授、新泽西理工学院许晓阳教授团队合作,在 Nature Communications 期刊发表了题为:mRNA lipid nanoparticle-mediated pyroptosis sensitizes immunologically cold tumors to checkpoint immunotherapy 的研究论文。
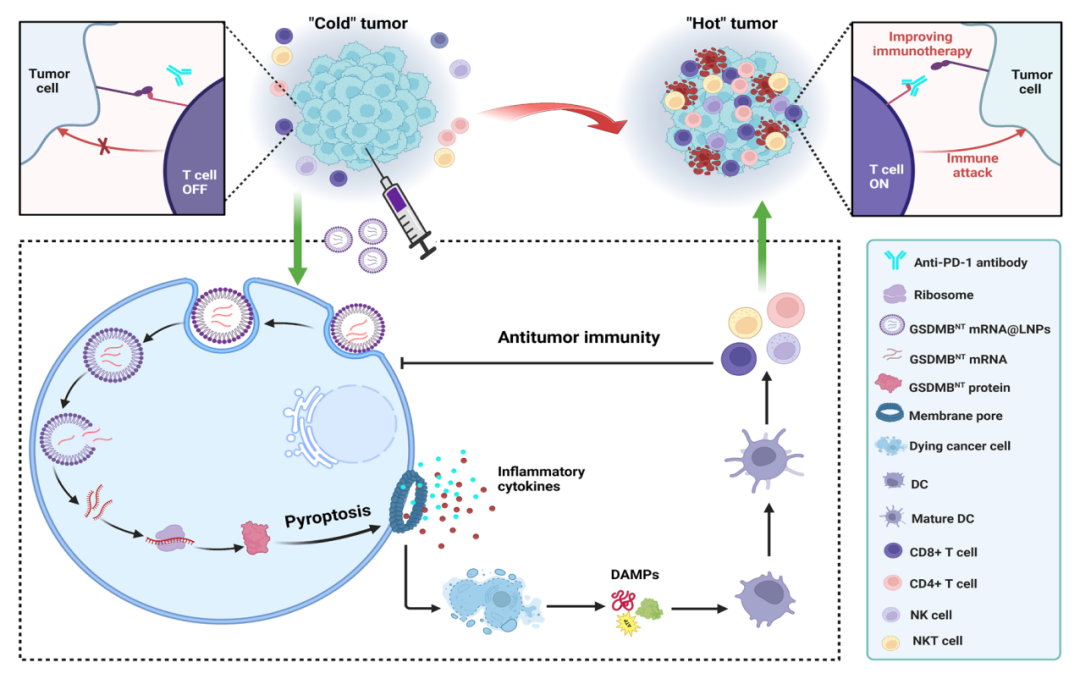
该研究提出了一种基于mRNA的细胞焦亡纳米药物治疗方法,它能够启动癌症免疫周期,将冷肿瘤转化为炎症细胞因子表达和T细胞浸润的热肿瘤,从而有效治疗免疫冷肿瘤。

细胞焦亡(pyroptosis)是一种炎症性程序性细胞死亡,由gasdermin(GSDM)家族蛋白的蛋白水解性裂解触发。GSDM通常通过其N端和C端结构域的分子内相互作用而自我抑制。在连接区被特异性半胱氨酸天冬氨酸蛋白酶和其他蛋白酶裂解后,坏死性端结构域形成低聚物并转移到质膜。游离N端结构域与脂质成分结合并在细胞膜上并打孔,导致质膜快速破裂,并释放危险相关分子模式(DAMP)和促炎细胞因子。免疫细胞识别特定的DAMP,进而触发一系列免疫反应,包括免疫细胞的激活和浸润。此外,通过焦亡孔释放的促炎细胞因子有助于逆转免疫抑制性肿瘤微环境(TME)。
尽管这些发现令人鼓舞,但许多癌症中GSDM的低表达和复杂的裂解过程阻碍了通过递送蛋白酶来触发细胞焦亡以产生抗肿瘤免疫。
研究团队推测通过直接传递N末端GSDM结构域诱导的细胞焦亡是在癌症免疫周期中引发一系列事件并将冷肿瘤转化为热肿瘤的有效方法。
基于mRNA纳米药物的基因治疗具有广阔的临床应用前景。最近,该成功开发了一种可合成的可电离阳离子脂质纳米颗粒(AA3-Dlin LNPs)的制剂,该制剂具有良好的安全性和较高的体内外mRNA翻译效率。mRNA-LNPs与GSDM协同激活细胞焦亡,有望在肿瘤治疗中发挥重要作用。
在该研究中,我们提出了一种基于mRNA的纳米医学方法,其中AA3-Dlin LNP配方封装了一个编码GSDMB N-端结构域的单剂mRNA——GSMDBNT mRNA@LNP。开发的GSMDBNT mRNA@LNP配方由可电离阳离子脂质(AA3-Dlin)、磷脂、胆固醇和PEG自组装,GSMDBNT mRNA通过静电相互作用被包裹在LNP内。
研究团队期望这种LNP可以被递送到肿瘤组织中,在那里,mRNA被翻译为GSDMB蛋白的端结构域,并直接触发细胞焦亡,而不需要蛋白酶裂解。
细胞焦亡具有诱导免疫细胞死亡、启动促炎细胞因子释放以及激活和招募肿瘤内免疫细胞的能力,进而导致一系列事件,进一步促进细胞死亡、细胞因子释放和免疫应答激活。由此产生的正反馈回路可创建有利的免疫原性热肿瘤微环境,使癌细胞对免疫检查点阻断(ICB)介导的免疫治疗敏感,显示出优于单药治疗的肿瘤抑制作用。
体外细胞实验结果表明,即使由单药GSMDBNT mRNA@LNP触发的低水平肿瘤细胞焦亡也足以诱导稳定的免疫原性细胞死亡。
在多个免疫冷肿瘤小鼠模型中,研究结果表明,mRNA-LNP触发的细胞焦亡可以抑制肿瘤生长和延长小鼠模型总生存期,并伴有促炎细胞因子的刺激和促进肿瘤微环境中免疫细胞的募集。
此外,mRNA-LNP触发细胞焦亡还可以提高免疫检查点抑制剂(aPD-1)介导的免疫治疗的疗效,甚至在原位4T1乳腺癌和高度侵袭性B16F10黑色素瘤模型中实现肿瘤消除和长期生存。
此外,该研究还发现,mRNA-LNP触发细胞焦亡可以与aPD--1介导的免疫治疗有效协同治疗效果,诱导局部免疫应答,进而产生全身效应,根除黑色素瘤和抑制远端肿瘤的生长。
综上所述,该研究表明,基于mRNA的细胞焦亡纳米药物提供了一种简单而高效的策略,以实现强大的抗肿瘤免疫和增强免疫冷肿瘤的免疫治疗效果。更重要的是,该研究提供了一个通用平台,有望扩展到免疫检查点阻断疗法之外的其他免疫治疗方法,具有很高的转化应用前景。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


