Nature:揭示CRISPR分子剪刀的起源---转座子编码的核酸酶利用向导RNA促进转座子自身的传播
来源:生物谷原创 2023-10-17 15:43
基因组工程可能是医学的未来,但它依赖于数十亿年前在原始细菌中取得的进化进步,而原始细菌是最初的基因编辑大师。科学家们对这些古老的基因编辑系统进行改造,推动它们完成更加复杂的基因编辑任务。然而,要发现新
基因组工程可能是医学的未来,但它依赖于数十亿年前在原始细菌中取得的进化进步,而原始细菌是最初的基因编辑大师。科学家们对这些古老的基因编辑系统进行改造,推动它们完成更加复杂的基因编辑任务。然而,要发现新工具,有时需要回顾过去,了解细菌最初如何创建原始的基因编辑系统,以及构建的原因。

在一项新的研究中,美国哥伦比亚大学的Sam Sternberg和他的博士后Chance Meers博士回顾了CRISPR-Cas9的前身---它们潜伏在所谓的“跳跃基因(jumping gene)”中---以揭示CRISPR的DNA剪刀是如何进化的。他们的发现揭示了数千种新发现的DNA剪刀是如何工作的,以及如何将它们设计成新的基因组工程技术。相关研究结果近期发表在Nature期刊上,论文标题为“Transposon-encoded nucleases use guide RNAs to promote their selfish spread”。
CRISPR-Cas9 来自跳跃基因
在细菌体内,CRISPR-Cas9 在保护细胞免受病毒感染方面发挥着至关重要的作用。在向导RNA(gRNA)的帮助下,这些分子剪刀首先识别入侵病毒的 DNA,然后切割病毒基因组。
几年前,科学家们将CRISPR-Cas9的起源追溯到转座子(transposon)。转座子是一种可移动的遗传因子,也被称为跳跃基因,通过一种称为转座的神秘过程,从基因组中的一个位置跳到另一个位置。
Sternberg说,“我们实验室研究的许多生物课题都是在一种生命形式从另一种生命形式中窃取基因时产生的---例如,细菌从病毒、质粒或转座子等可移动的遗传因子中窃取基因,然后这些基因被重新利用来执行类似的生化反应,但功能完全不同。”
这种转座子关联性很快让人们发现了一个潜在的新编辑工具宝库:成千上万个古老的转座子仍然活跃在细菌基因组中,每个转座子都携带一种RNA引导的DNA核酸酶,基因组工程师(人类)可能对这些DNA核酸酶进行编程以便切割DNA。
基因组工程师们现在正致力于利用这些系统,但对Sternberg和Meers来说,一个重要的问题仍未得到解答。
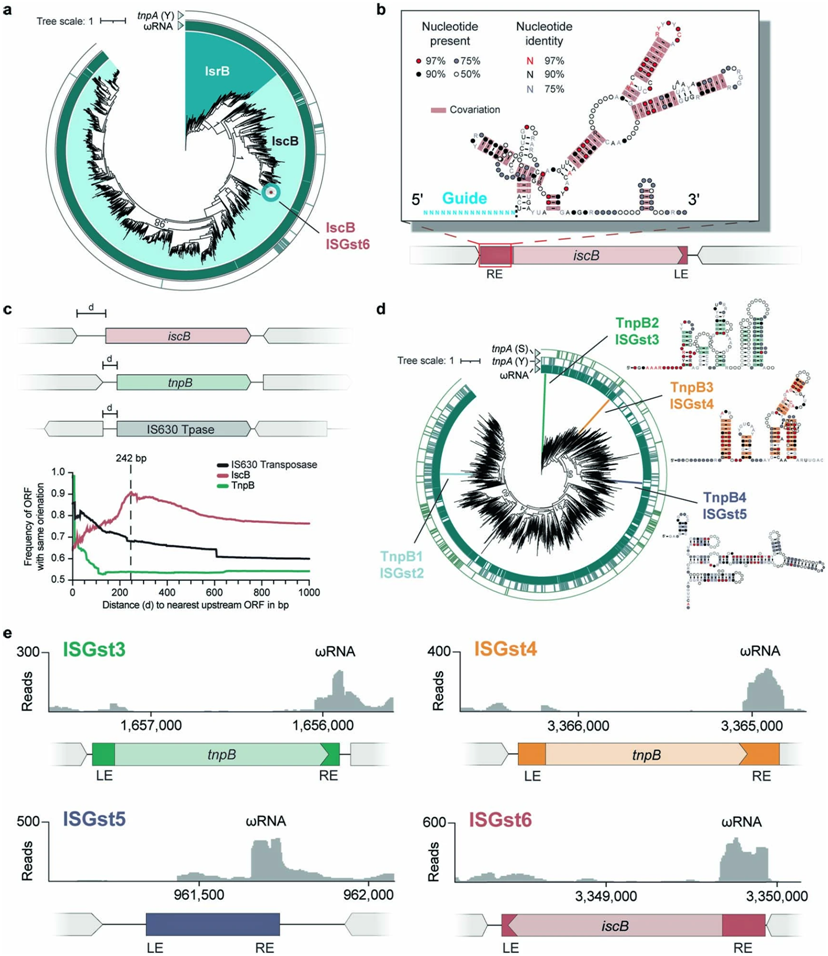
对IscB和TnpB同源物的生物信息学分析。图片来自Nature, 2023, doi:10.1038/s41586-023-06597-1。
Meers说,“这些转座子在它们自己的酶---称为转座酶---的帮助下跳进跳出基因组。它们不需要 DNA 剪刀,也不需要g RNA。那么,它们为什么携带 RNA 引导的 DNA 剪刀的基因呢?”
没有DNA剪刀,转座子就会灭绝
这是一个难以破解的难题。Meers解决的第一个难题是找到合适的具有许多活性转座子拷贝的细菌,并将其作为模型系统。实验室中常见的大肠杆菌并不是最好的起点,因此Meers选择了嗜热脂肪地芽孢杆菌(Geobacillus stearothermophilus),这是一种嗜热细菌,拥有数十个活跃的跳跃基因。
Meers还从转座子的角度研究了这个问题,开发出了功能强大的检测方法,可以捕捉到在细菌基因组中移动、在质粒中跳进跳出以及从一种细菌菌株跳到另一种细菌菌株的过程中的跳跃基因。Sternberg说,“如果没有这种方法,你最终只能孤立地研究这些DNA剪刀,而无法从整体上了解整个故事。”
有了这些检测方法,Meers 和 Sternberg 在实验室同事们的帮助下,深入研究了转座子的移动方式,结果表明,如果没有这些DNA 剪刀,跳跃基因可以跳到新的位置,但很容易迅速灭绝。(细菌不断试图使包括转座子在内的可移动遗传因子失活。)
这些类似于CRISPR的分子剪刀在切割DNA后,引导转座子的拷贝回到它跳跃的位置,从而防止了基因灭绝。
Meers说,“通过这种‘剪切和复制’策略,转座子的增殖速度可以超过它的永久消失的速度。实际上,自然界最强大的基因组编辑器最初是为了将自己编辑到基因组中,自私地促进它们自己的传播。”
还能找到更多版本的CRISPR吗?
由于CRISPR-Cas是由细菌王国中成千上万个拷贝的转座子进化而来的,因此大自然很可能已经从这些强大的转座子基因中创造出了其他的等待着人们去发现的系统。
Sternberg说,“很难相信,进化到CRISPR-Cas基因后,就不再发明分子剪刀了。肯定还有其他系统在起作用,如果我们找到了它们,或许也能借用这些基因,并将它们用于另一个目的:对人类细胞基因组进行改造。”(生物谷 Bioon.com)
参考资料:
1. Chance Meers et al. Transposon-encoded nucleases use guide RNAs to promote their selfish spread. Nature, 2023, doi:10.1038/s41586-023-06597-1.
2. The Genesis of CRISPR’s Molecular Scissors
https://www.cuimc.columbia.edu/news/genesis-crisprs-molecular-scissors
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


