Nature:颠覆教科书!新研究揭示逆转录转座子劫持宿主细胞的修复机制形成环状DNA
来源:生物谷原创 2023-07-25 09:45
和病毒一样,一种有点寄生的称为逆转录转座子(retrotransposon)的DNA序列被发现借用细胞自身的机制来实现它本身的目标。
和病毒一样,一种有点寄生的称为逆转录转座子(retrotransposon)的DNA序列被发现借用细胞自身的机制来实现它本身的目标。
在一项新的研究中,来自美国杜克大学的研究人员发现逆转录转座子劫持了细胞DNA修复功能中鲜为人知的一部分,将自身封闭成环状,然后形成匹配的双链。这一发现颠覆了40年来的传统观点,即这些环只是不良基因复制的无用副产品。它还可能为癌症、病毒感染和免疫反应提供新的见解。相关研究结果于2023年7月12日在线发表在Nature期刊上,论文标题为“Retrotransposons hijack alt-EJ for DNA replication and eccDNA biogenesis”。

逆转录转座子是大约7000个碱基长的DNA片段,它们将自己复制并粘贴到植物和动物基因组的不同部分。通过这种方式,它们在重写DNA和调节细胞如何使用它的基因方面发挥作用。逆转录转座子被认为是驱动进化的基因变异和创新的幕后推手,并且遗传自父母双方。
许多研究已表明,染色体外的这些DNA环在某种程度上与癌症的发生和进展有关,部分原因是它们的DNA序列中含有导致癌症的致癌基因。导致艾滋病的逆转录病毒HIV也形成环状DNA。
论文通讯作者、杜克大学药理学与癌症生物学助理教授Zhao Zhang说,“我认为这些DNA环是基因组动态、动物进化甚至影响我们日常生活的源泉。但我们仍处于了解它们的功能的过程中。”
逆转录转座子非常普遍---它们占人类基因组的40%,占玉米基因组的75%以上---但它们如何复制自己以及复制到哪里一直是个谜。
Zhang举着一本厚厚的关于逆转录病毒的教科书,他在这项新的研究中参考了这本教科书。他说,书上说,这些环状序列是“通过重新组合线性DNA的两端而产生的,只是一个死胡同,是复制失败的副产品”。
在早些时候对果蝇卵的研究中,Zhang及其研究团队已经确定遗传性的逆转录转座子利用支持果蝇卵的“营养细胞(nurse cell)”作为工厂,制造许多自身的拷贝,然后分布在果蝇发育中的卵的整个基因组中。这一模型系统使得他们能够进一步放大研究范围,以了解更多有关逆转录转座子的信息。
在这项新的研究中,他们意外地发现大多数新添加的逆转录转座子都是以这种环状形式存在的,而不是整合到宿主的基因组中。然后,他们进行了一系列实验,逐一敲除细胞的DNA修复机制,以弄清这些环是如何形成的,以及在哪里形成的。
答案揭晓了: 一种鲜为人知的能够修复双链断裂的称为替代性末端连接DNA修复(alternative end-joining DNA repair, alt-EJ)的DNA修复机制。逆转录转座子序列利用这种宿主修复机制的这一部分将其单链DNA的末端缝合在一起,然后利用其DNA合酶(DNA synthase)构建出匹配的双链。此外,他们还证实,这一过程也适用于人类细胞。
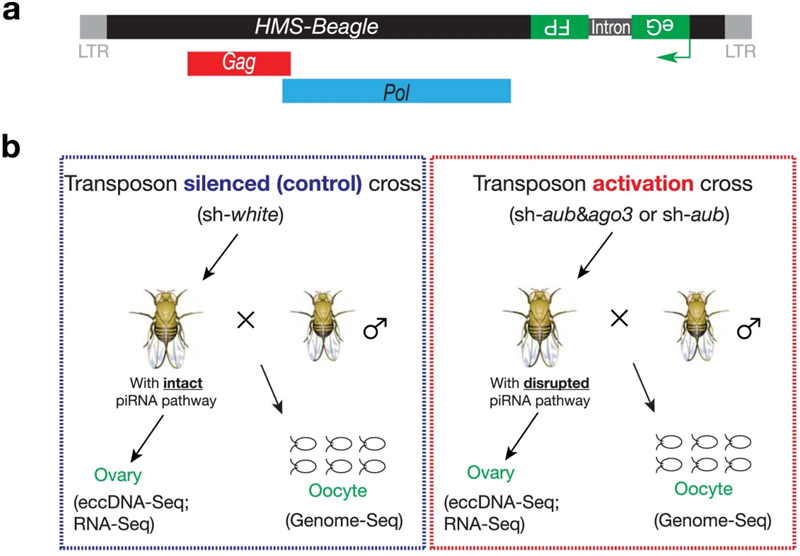
工程化的HMS-Beagle报告序列主要形成染色体外环状DNA(eccDNA)。图片来自Nature, 2023, doi:10.1038/s41586-023-06327-7。
因此,逆转录转座子并不是马马虎虎的意外;它们实际上是劫持了细胞分子机器的一部分来制造更多的自身,就像病毒所做的那样。
Zhang说,“我们的发现实际上推翻了教科书上的理论。我们发现,教科书中提出的重组事件对逆转录转座子形成DNA环并不重要。相反,是alt-EJ途径驱动了这些DNA环的产生。”
Zhang说,“我的实验室目前正试图测试所形成的DNA环是否可以作为制造新基因组插入的中间物。我们还在测试这些DNA环是否能被我们的免疫系统感知以触发免疫反应。”
Zhang说,“在逆转录病毒领域和逆转录转座子领域,人们认为它们形成的环状DNA只是一个小事件,但我们的研究将环状DNA带到了中心舞台。人们应该更多地关注环状DNA。” (生物谷 Bioon.com)
参考资料:
Fu Yang et al. Retrotransposons hijack alt-EJ for DNA replication and eccDNA biogenesis. Nature, 2023, doi:10.1038/s41586-023-06327-7.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


