RORγt蛋白修饰与il -17介导的炎症反应
来源:本站原创 2021-10-29 10:44
RORγt是细胞因子白介素(IL)-17的主要转录因子,在小鼠和人类的Th17细胞、γδT细胞和3型先天淋巴样细胞中明确表达。
RORγt是细胞因子白介素(IL)-17的主要转录因子,在小鼠和人类的Th17细胞、γδT细胞和3型先天淋巴样细胞中明确表达。由于IL-17表达异常与几种人类炎症性疾病密切相关,RORγt IL-17轴一直是激烈研究的焦点。最近,一些研究表明RORγt通过多种翻译后机制被修饰,包括泛素化、乙酰化、sumo化和磷酸化。
这篇综述讨论了翻译后修饰如何调节RORγt功能及其在调节il -17驱动的炎症中的转换。对这些途径的广泛了解对于明确RORγt+IL-17+细胞的致病作用以及开发针对IL-17驱动的疾病(如多发性硬化症、银屑病、类风湿关节炎、系统性红斑狼疮和炎症性肠病)的假设治疗策略至关重要。
图片来源:https://pubmed.ncbi.nlm.nih.gov/34635393/
白介素(IL)-17对哺乳动物宿主抵御真菌和细菌感染至关重要。然而,IL-17表达异常及其下游信号通路参与了多种炎症性疾病,如炎症性肠病(IBD),多发性硬化症(MS)、银屑病、系统性红斑狼疮(SLE)、类风湿性关节炎(RA)和哮喘。在发现辅助性T细胞的Th17亚群是IL-17的主要来源后,IL-17得到了广泛的关注。此外,在小鼠、人类和非人类灵长类动物中,CD8+ T细胞、γδT细胞、自然杀伤T
(NKT)细胞和3型先天淋巴细胞也能产生IL-17。
RORγt是视黄酸相关孤儿受体(ROR)家族转录因子的成员。Rorc /小鼠自身免疫性疾病减弱,例如,在实验性自身免疫性脑脊髓炎(EAE)和实验性银屑病中,这些临床症状与缺乏组织浸润的Th17细胞有关。近年来,人们对RORγt如何诱导IL-17表达和CD4+ T细胞向Th17细胞分化的研究给予了大量关注。为了诱导这些过程,RORγt与其他几种转录因子合作,包括干扰素调节因子4 (IRF4)、信号传感器和转录激活因子3 (STAT3)、Bob1和碱性亮氨酸拉链转录因子(BATF)。
在这篇综述中,作者讨论了翻译后修饰如泛素化、sumo化、乙酰化和磷酸化如何调节RORγt功能、辅激活子或辅抑制子的招募以及该转录因子在小鼠和人类中的降解。广泛的这一领域知识对于开发选择性和安全的RORγt活性调节剂,以靶向RORγt- il -17通路,抑制自身免疫反应和炎症至关重要。
泛素结合在免疫细胞中起着重要的调节作用。泛素化是一个多酶的生化过程,由三种酶进行,即ub - activated (E1)、Ub-conjugating (E2)和Ub-ligating (E3)酶。ITCH是一种E3连接酶,由一个n端C2结构域(蛋白激酶C相关)、四个WW结构域(ww14)和一个C端HECT结构域组成。ITCH 通过靶向 RORγt 在小鼠和人类 Th17 细胞中泛素化来抑制 IL-17 的产生。ITCH 蛋白通过其 WW 结构域与 RORγt 上保守的 PPLY 区域结合并导致其降解,从而抑制 IL-17 的表达。
因此,Itch / 小鼠由于严重的结肠炎症而自发地发生直肠脱垂,这与结肠固有层淋巴细胞增加 IL-17 的表达有关。与这些数据一致,另一项研究报告称,与野生型对照相比,缺乏 NDFIP1 (Ndfip1 / )(一种 ITCH 共激活剂)的小鼠在肺和肠粘膜中表现出数量增加的 Th17 细胞。NDFIP1 与 ITCH 结合并在 T 细胞受体 (TCR) 连接后通过将 Ub 结合酶 E2 募集到 ITCH 来促进其在鼠 CD4+ T 细胞中的连接酶活性。
NDFIP1 与 ITCH 结合并在 T 细胞受体
(TCR) 连接后通过将 Ub 结合酶 E2 募集到 ITCH 来促进其在鼠 CD4+ T 细胞中的连接酶活性。此外,有报道称Ndfip1 / Th17细胞转移到Rag1 /小鼠后具有高度的结肠原性,表明至少在小鼠中,Ndfip1 - itch通路在il -17介导的结肠炎症调节中发挥了关键作用。
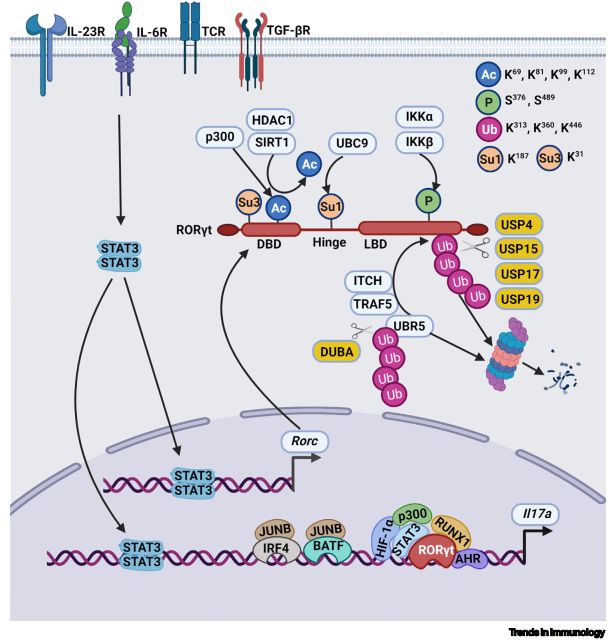
T细胞受体(TCR)和细胞因子信号导致Rorc基因的转录。
图片来源:https://pubmed.ncbi.nlm.nih.gov/34635393/
RORγt IL-17轴已成为一些自身免疫性疾病的关键致病因素,如银屑病、SLE、RA和IBD。尽管抗IL-17A和IL-17Rs的抗体在治疗银屑病方面具有显著的疗效,但人们仍然担心IL-17活性在全身失活的潜在风险,IL-17活性在粘膜表面提供了必要的宿主防御和适当的屏障功能。这种多样化和非冗余的翻译后机制是否有必要促进或关闭ror γt介导的IL-17表达尚不清楚。
这些途径可能单独不够充分,需要在多个层面进行协调努力。每个调节分子的刺激或抑制率可能在不同信号转导阶段发挥独特作用,以调节th17介导的炎症反应。此外,这些通路可能对非致病性和致病性Th17细胞有不同的调节作用。此外,RORγt的不同天然配体的结合可能触发不同的RORγt翻译后修饰。这些问题的详细机制知识将有助于开发安全、有选择性的药物靶点,以管理il -17驱动的疾病,作者认为这肯定值得未来的关注。(生物谷 Bioon.com)
参考文献
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。




