华中科技大学王桂华团队揭示PD-L1甲基化抑制PD-1/PD-L1抑制剂效果
来源:生物世界 2023-06-02 11:19
癌细胞利用PD-L1的表达来抑制T细胞介导的免疫监视,PD-L1的胞外结构域和PD-1之间的相互作用可以诱导PD-1的构象变化,从而通过抵消T细胞激活信号来抑制抗肿瘤免疫。
癌细胞利用PD-L1的表达来抑制T细胞介导的免疫监视,PD-L1的胞外结构域和PD-1之间的相互作用可以诱导PD-1的构象变化,从而通过抵消T细胞激活信号来抑制抗肿瘤免疫。靶向PD-1/PD-L1通路的单克隆抗体已被批准用于多种癌症的治疗,包括非小细胞肺癌、结直肠癌、肝癌、宫颈癌、胃癌和黑色素瘤等等,并具有持久的临床益处。
然而,大多数癌症类型的患者对靶向PD-1/PD-L1相互作用的治疗没有反应或只是暂时反应,多项临床试验已经提出将PD-L1阳性作为预测抗PD-1或抗PD-L1治疗反应的生物标志物,但其中的客观反应仍低于50%。PD-L1高表达的癌症患者对抗PD-1或抗PD-L1治疗无反应的潜在机制尚不清楚。
2023年5月26日,华中科技大学同济医学院附属同济医院王桂华教授团队在 Science 子刊 Science Advances 上发表了题为:PD-L1 methylation restricts PD-L1/PD-1 interactions to control cancer immune surveillance 的研究论文。
该研究发现,PD-L1的Lys162位点(K162)可被SETD7甲基化,被LSD2去甲基化。PD-L1的K162甲基化调控PD-1/PD-L1相互作用,并明显增强对T细胞活性的抑制,控制癌症免疫监视。该研究证明了PD-L1高甲基化是抗PD-L1治疗耐药的关键机制,PD-L1的K162甲基化:PD-L1比例是预测抗PD-1/PD-L1治疗敏感性的更准确的生物标志物。
这些发现为PD-1/PD-L1通路的调控提供了见解,确定了这一关键免疫检查点的修饰,并强调了对PD-1/PD-L1阻断治疗反应的预测性生物标志物。

目前针对PD-1/PD-L1通路的治疗是通过阻断它们的相互作用来实现的,因此,这种免疫检查点相互作用状态可能是一种关键的预后和预测性生物标志物,能够取代传统的蛋白表达水平,用于对免疫检查点抑制剂治疗的癌症患者进行分类。
最近的研究表明,PD-1/PD-L1配位评分可以高度预测抗PD-1/PD-L1免疫治疗的反应。因此,了解调控PD-1/PD-L1相互作用的机制通路非常重要,这可以为提高PD-1/PD-L1阻断治疗癌症患者的临床反应率和疗效提供分子基础。
在过去的几年中,研究人员一直关注PD-1/PD-L1通路的遗传、转录和转录后调控。许多细胞内和细胞外因子,例如IFN-γ、TGF-β和Myc,在转录水平调控PD-L1的表达。最近的一些研究发现,PD-L1和PD-1也受到蛋白质翻译后修饰的调节,例如泛素化、糖基化、磷酸化、棕榈酰化和乙酰化修饰。这些修饰调控PD-L1的稳定性和PD-1/PD-L1的相互作用,或促进PD-L1从膜向细胞核的易位。
异常组蛋白和非组蛋白甲基化是癌症的一个众所周知的标志,它可以由赖氨酸(Lys)和精氨酸(Arg)残基甲基化。甲基化通过对蛋白-蛋白间相互作用、蛋白-DNA间相互作用、蛋白质稳定性和蛋白质的亚细胞定位的影响调控许多细胞过程。因此,几种组蛋白甲基转移酶抑制剂目前正在临床试验中进行评估。
PI3K、Akt、NF-κB或雌激素受体信号的关键成分也会发生甲基化。爱这项最新研究中,研究团队发现Akt K64甲基化对Akt激活和肿瘤发生至关重要,而SMAD3甲基化对TGF-β通路激活和肿瘤转移至关重要。
在这项研究中,研究团队目标是为PD-1/PD-L1通路的调控提供此前未知的新见解,并开发对PD-1/PD-L1阻断治疗反应的预测性生物标志物。
该研究发现,PD-L1的Lys162位点(K162)被组蛋白赖氨酸N-甲基转移酶(SETD7)甲基化,并且通过赖氨酸特异性组蛋白去甲基化酶2(LSD2)触发PD-1/PD-L1相互作用。同时,异常的IL-6接收可抑制SETD7的表达,降低PD-L1的Lys162位点(K162)的甲基化。
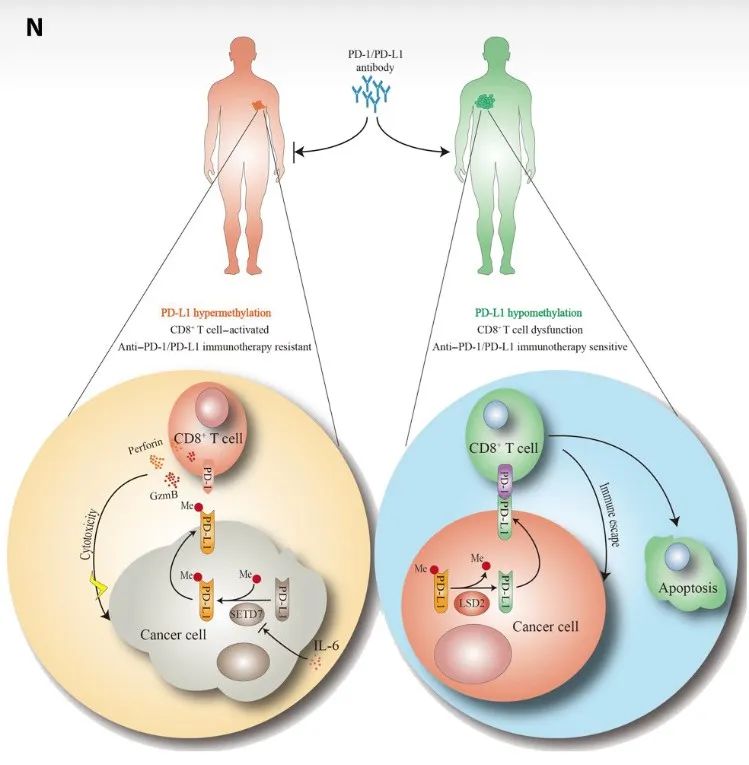
此外,该研究还证实了PD-L1高甲基化状态有助于抗PD-1治疗耐药性,并提出了一种通过检测PD-L1的Lys162位点(K162)甲基化水平来预测PD-1/PD-L1阻断治疗效果的策新略。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


