Cell Stem Cell:陈水冰/杨柳柳等构建人多能干细胞来源的血管化的巨噬细胞-胰岛类器官揭示胰岛β细胞焦亡的机制
来源:生物探索 2024-09-08 10:32
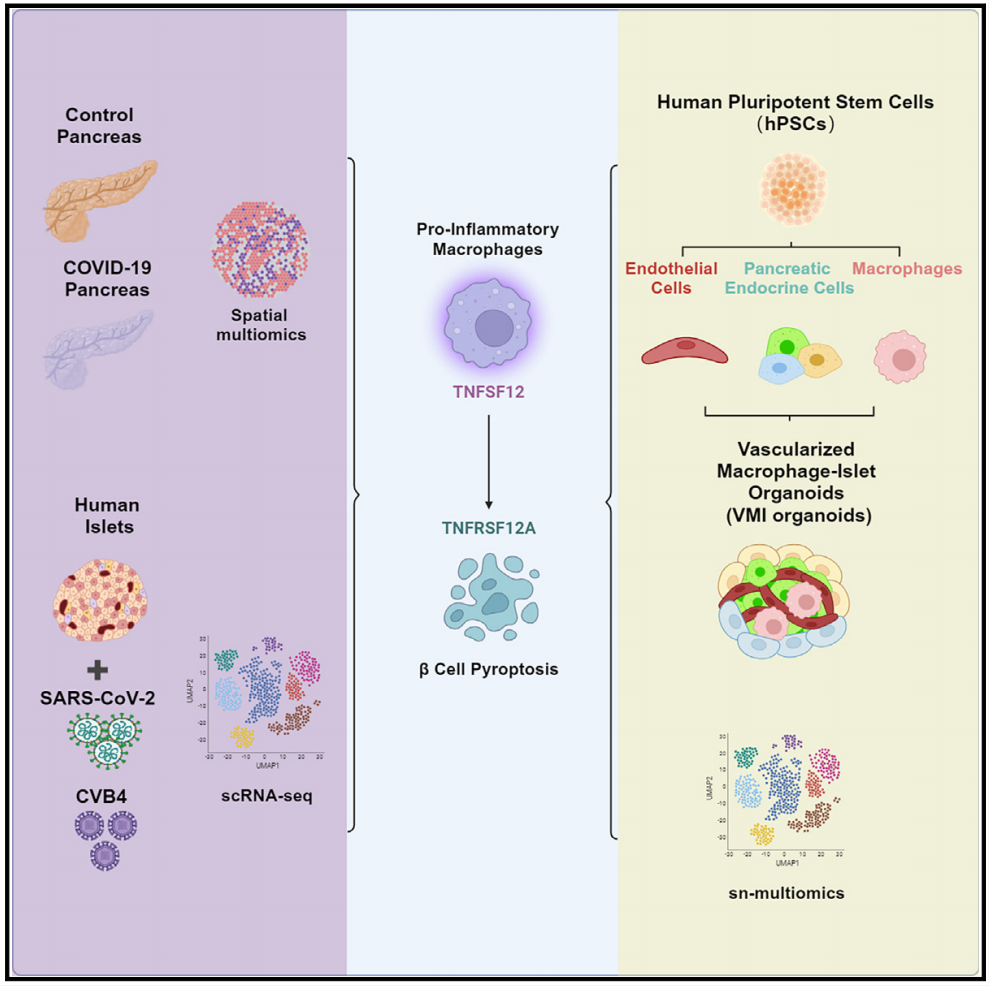
为了研究新冠患者以及病毒感染的胰岛β细胞的焦亡是由病毒直接感染引起的还是由于促炎型巨噬细胞的活化诱导的,该团队构建了人多能干细胞来源的血管化的巨噬细胞-胰岛类器官模型。
来自康奈尔大学威尔医学院的陈水冰,Robert E. Schwartz和杨柳柳(现为中国医学科学院血液病医院/血液学研究所的研究员)等的研究团队在Cell Stem Cell杂志发表题为Human Vascularized Macrophage-Islet Organoids to Model Immune-Mediated Pancreatic β cell Pyroptosis upon Viral Infection的研究论文。该研究通过对对照组和新冠患者(COVID-19)的胰腺组织样品进行空间多组学分析以及构建人多能干细胞来源的血管化的巨噬细胞-胰岛类器官(vascularized macrophage-islet organoids, VMI organoids)模型发现新冠患者中,促炎型巨噬细胞通过TNFSF12-TNFRSF12A通路诱导胰岛β细胞的焦亡(Pyroptosis)。

越来越多的证据表明,新型冠状病毒病(COVID-19)与糖尿病之间存在强烈联系。美国疾病控制与预防中心(CDC)的研究报告称,与未患新冠肺炎的人相比,18岁以下患有新冠肺炎的人更倾向于新发糖尿病。并且,新冠疫情开始后,1型糖尿病(T1D)和2型糖尿病(T2D)的发病率明显升高。除了新冠病毒(SARS-CoV-2)外,许多研究表明病毒感染与T1D之间存在相关性,包括肠道病毒,如B族柯萨奇病毒,以及轮状病毒、腮腺炎病毒和巨细胞病毒等。柯萨奇病毒B4(CVB4),是一种正义单链RNA病毒,是从新诊断的T1D病人中分离出来的,可以在体外感染并导致β细胞损伤。该团队前期构建了人多能干细胞向三胚层多种组织细胞及类器官分化的平台,通过对这些分化得到的细胞和类器官进行SARS-CoV-2感染,首先鉴定并报道了胰腺内分泌细胞可以被SARS-CoV-2感染。然而,除了病毒直接感染导致的组织细胞损伤外,其他因素,尤其是炎症所导致的组织细胞损伤也在新冠患者的疾病进程中发挥了关键作用。然而,目前缺少合适的人类疾病模型来研究免疫细胞在病毒感染过程中造成的组织损伤。
为了检测免疫细胞是否参与胰腺胰岛β细胞的损伤,团队收集了对照组和新冠患者的胰腺组织样品,对其进行空间多组学分析。研究发现,与对照组相比,新冠患者的胰岛中表达胰岛素(INS)的β细胞的比例明显降低。并且,在新冠患者的胰岛内有促炎型巨噬细胞的活化和富集。之后,团队分离了人的胰岛组织细胞,对其进行SARS-CoV-2以及CVB4的感染和单细胞转录组分析(scRNA-seq)。研究发现,SARS-CoV-2和CVB4均可导致胰岛内促炎型巨噬细胞的活化以及胰岛β细胞的焦亡。
为了研究新冠患者以及病毒感染的胰岛β细胞的焦亡是由病毒直接感染引起的还是由于促炎型巨噬细胞的活化诱导的,该团队构建了人多能干细胞来源的血管化的巨噬细胞-胰岛类器官模型。团队首先将胚胎干细胞(hESCs)分别经过多种因子诱导分化为胰腺内分泌细胞(包含β细胞、α细胞和δ细胞等),巨噬细胞和内皮细胞,之后将分别分化得到的细胞在优化的类器官培养条件下组装成类器官(VMI organoids)。团队进一步对该类器官模型中的关键细胞成分进行了免疫荧光染色分析和功能评价,发现巨噬细胞和内皮细胞的存在对β细胞响应高浓度葡萄糖和KCL的功能有促进作用。同时,内皮细胞和巨噬细胞在该类器官模型中也保留了其特有的功能。通过进一步在体外诱导并构建包含促炎型巨噬细胞的VMI organoids,该团队也证明了促炎型巨噬细胞确实可以引起胰岛β细胞的焦亡。
在分子机制方面,研究团队通过对巨噬细胞和胰岛β细胞之间的细胞通讯(cell chat)进行分析和验证,发现促炎型巨噬细胞通过TNFSF12-TNFRSF12A这一信号通路来诱导胰岛β细胞的细胞焦亡。使用TNFSF12的中和抗体可以缓解病毒(SARS-CoV-2或CVB4)诱导的胰岛或促炎型巨噬细胞诱导的类器官模型中β细胞的焦亡。最后,研究人员也在新冠患者的胰腺组织样本中,确认了胰腺内胰岛β细胞的细胞焦亡现象,并且这种现象与糖尿病不相关。
免疫细胞在组织稳态及疾病的发生发展,尤其是感染性疾病中发挥重要作用。然而,研究免疫细胞介导的宿主组织细胞损伤的人类模型很少。本研究构建了人多能干细胞(hPSC)衍生的血管化巨噬细胞-胰岛类器官(VMI organiods),为研究免疫细胞介导的宿主组织细胞损伤提供了有价值的工具,并揭示了病毒暴露期间β细胞潜在的损伤机制。
模式图(Credit: Cell Stem Cell)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


