Nat Commun:呼吸道类器官突破人鼻病毒C培养难题,开启呼吸道疾病研究新篇章!
来源:生物谷原创 2025-01-14 12:56
该研究针对难以在标准细胞系培养的HRV-C,利用呼吸道类器官培养系统,成功实现其连续传代培养,明确了气道和鼻类器官对其感染特性及免疫反应差异,还建立了病毒定量方法,为相关研究提供重要支撑。

在医学研究的前沿阵地,人鼻病毒C(HRV-C)始终是一个亟待攻克的关键难题。HRV-C作为引发急性上呼吸道感染的常见病毒,与下呼吸道感染及哮喘、慢性肺部疾病的恶化紧密相连,对人类健康构成了严重威胁。然而,其在标准细胞系中难以培养的特性,长期以来成为了深入探究其致病机制和防治策略的巨大阻碍。
回顾以往的研究历程,科研人员曾尝试利用手术切除的鼻窦黏膜和鼻息肉等初级组织来培养HRV-C。尽管在这一过程中,曾成功实现了个别毒株的培养,但随之而来的诸多问题却让这一方法难以持续推进。不同捐赠者的组织样本存在显著差异,这使得病毒生长表现出极大的不稳定性;组织获取的渠道极为有限,难以满足大规模研究的需求;实验过程中的标准化操作难以达成,导致实验结果的可靠性大打折扣;此外,组织在实验期间还容易发生降解,进一步增加了研究的难度。这些因素综合起来,使得利用初级组织培养HRV-C的方法无法成为一种通用且有效的研究手段。
在此困境中,类器官培养技术的兴起为HRV-C研究带来了新的曙光。呼吸道类器官源自干细胞,涵盖了胚胎干细胞、诱导多能干细胞以及原代组织中的器官特异性成体干细胞。这些类器官具有独特的生物学特性,能够自我更新并自发地组织形成复杂且功能完备的结构,高度还原了对应组织器官的细胞多样性和生理功能。
近日,香港大学Jie Zhou研究团队在Nat Commun发表了题为Human respiratory organoids sustained reproducible propagation of human rhinovirus C and elucidation of virus-host interaction的研究论文。在本研究中,科研团队巧妙地运用了此前构建的人类呼吸道类器官培养系统。这一系统在类器官的培养方面展现出了强大的功能,它能够高效地从原代肺组织中获取类器官,并确保其在长达半年的时间里实现稳定的扩增。通过特定的分化方案,这些类器官能够进一步成熟为与天然气道和肺泡上皮极为相似的气道类器官和肺泡类器官。其中,鼻类器官因其无创获取的优势以及对上部呼吸道上皮的出色模拟能力,在整个研究进程中发挥了不可或缺的作用。

研究人员首先对气道类器官展开了HRV-C感染实验。他们挑选了9份病毒载量各异的HRV-C阳性鼻咽标本,并将其接种到气道类器官上。实验结果令人振奋,其中8份标本成功地在气道类器官中引发了病毒的增殖,这一发现有力地证明了气道类器官对HRV-C具有一定程度的易感性。然而,在后续的病毒连续传代实验中,未经过特殊处理的气道类器官却遭遇了困境,无法顺利完成这一关键步骤。经过深入细致的研究,科研人员发现这是由于HRV-C感染引发了气道类器官强烈的抗病毒反应,从而阻断了病毒的连续传代过程。为了突破这一瓶颈,研究团队创新性地引入了CYT387。
CYT387是一种在医学领域用于治疗骨髓纤维化的药物,其作用机制在于能够有效抑制干扰素及干扰素刺激基因的表达。在CYT387的积极干预下,气道类器官成功实现了HRV-C的连续5次传代,并且子代病毒依然保持着较强的感染能力,为后续的研究工作提供了充足且稳定的病毒样本。
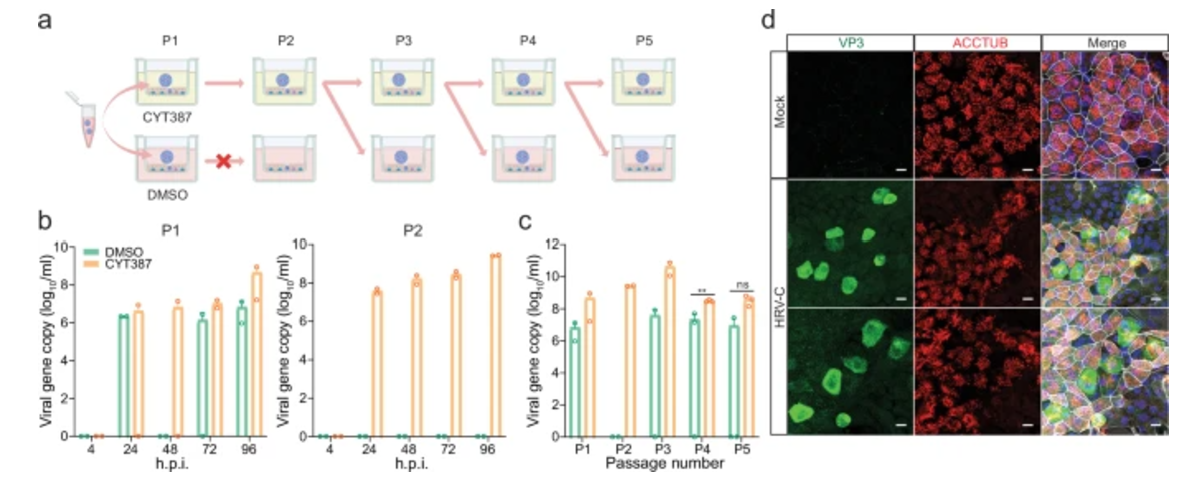
图1:CYT387使HRV-C在人类气道类器官中连续传代
与此同时,鼻类器官的研究也取得了重大突破。鼻类器官在细胞组成上与气道类器官存在相似之处,但在模拟上呼吸道上皮的精准度方面更胜一筹。令人欣喜的是,鼻类器官无需借助任何额外的辅助手段,就能够自发地支持HRV-C的连续传代。研究人员对不同亚型的HRV-C进行了全面且系统的测试,鼻类器官在每一次测试中都表现出了出色的病毒培养能力。在不同温度条件下的培养实验中,鼻类器官同样展现出了卓越的稳定性,病毒基因组在传代过程中始终保持着稳定的状态,为深入研究HRV-C的生物学特性提供了可靠的模型基础。
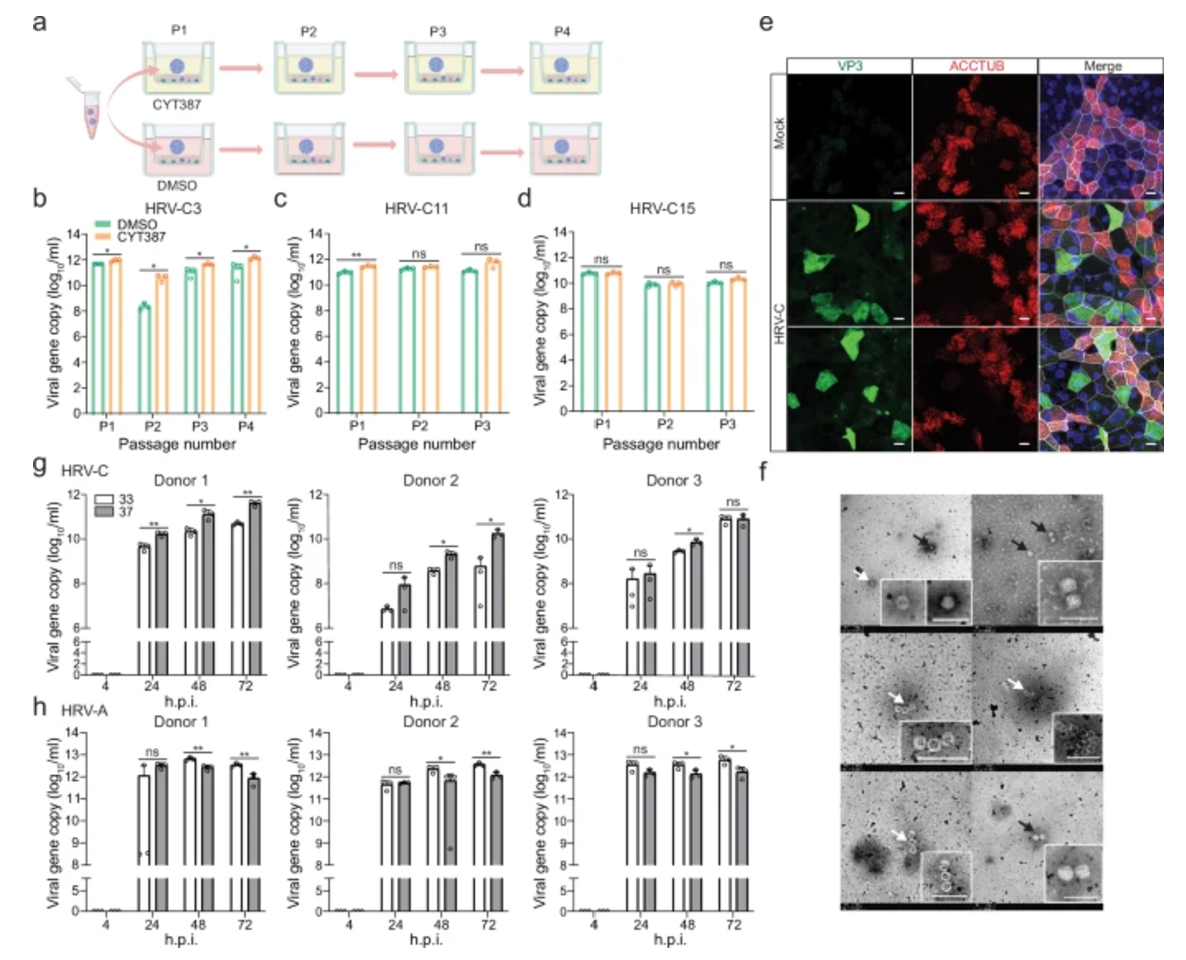
图2:人类鼻类器官维持HRV-C的连续传代
在对气道类器官和鼻类器官的对比研究中,科研人员发现了两者在应对HRV-C感染过程中的显著差异。鼻类器官对HRV-C的敏感性明显更高,能够为病毒的复制提供更为有利的环境,从而支持更活跃的病毒复制过程。相反,气道类器官在感染后则会迅速启动更为强烈的先天免疫反应,这一结论通过严谨的RNA测序和Poly(I:C)刺激实验得到了充分的验证,为进一步理解病毒-宿主相互作用机制提供了关键线索。在病毒感染机制的深入研究方面,科研人员还发现HRV-C受体CDHR3在气道和鼻类器官的纤毛细胞顶表面呈现出高度表达的状态。
通过巧妙地运用抗体阻断CDHR3,能够显著抑制病毒在鼻类器官中的生长,这一发现为抗病毒治疗策略的研发提供了新的靶点方向。此外,研究团队经过大量的筛选工作,确定的两种抗病毒药物也在实验中显示出了对HRV-C的有效抑制效果,并且成功建立了基于类器官的免疫荧光测定法,实现了对HRV-C感染性粒子的精准定量,为病毒感染的检测和监测提供了有力的工具支持。
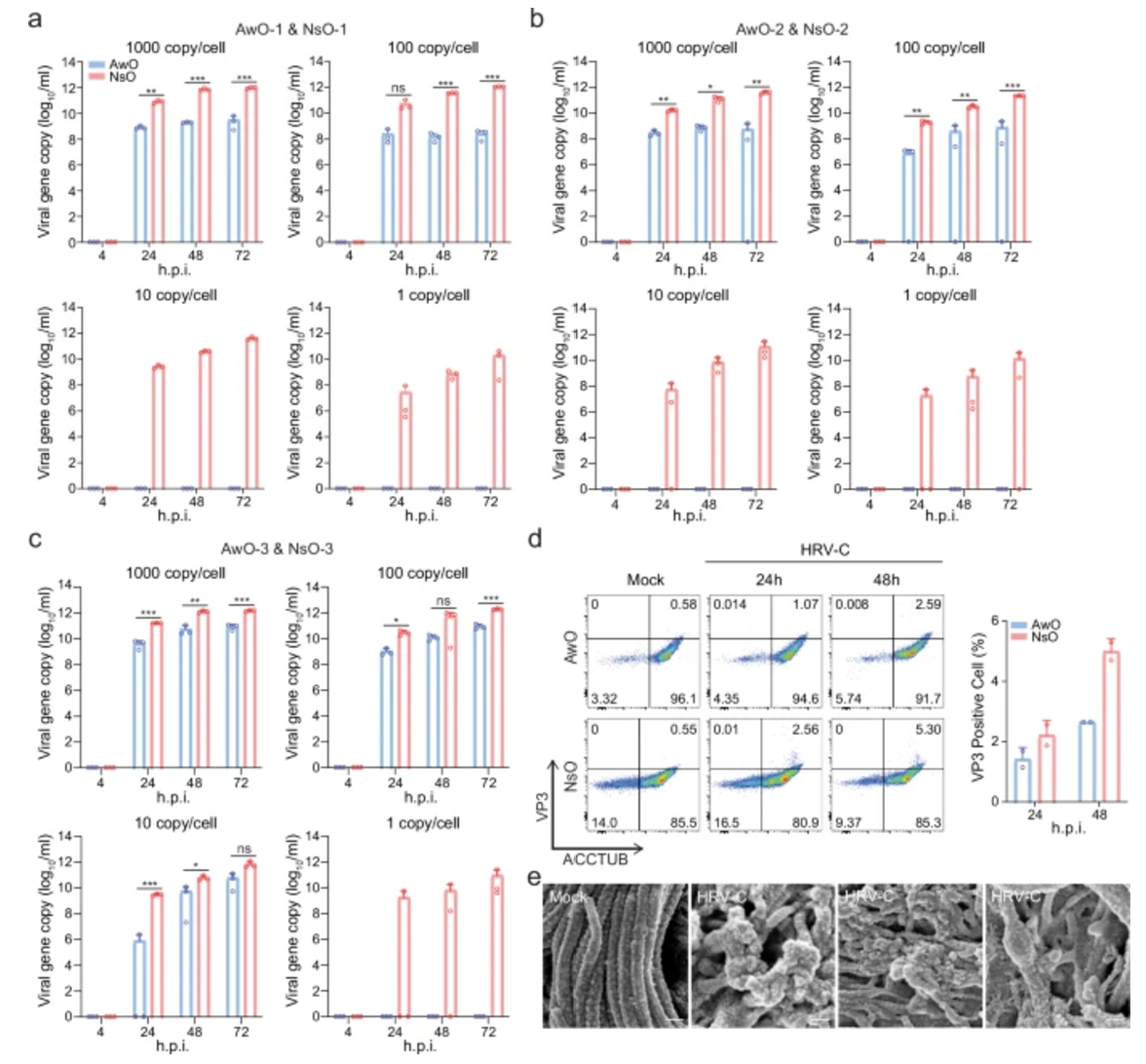
图3:鼻类器官比气道类器官对HRV-C更易感
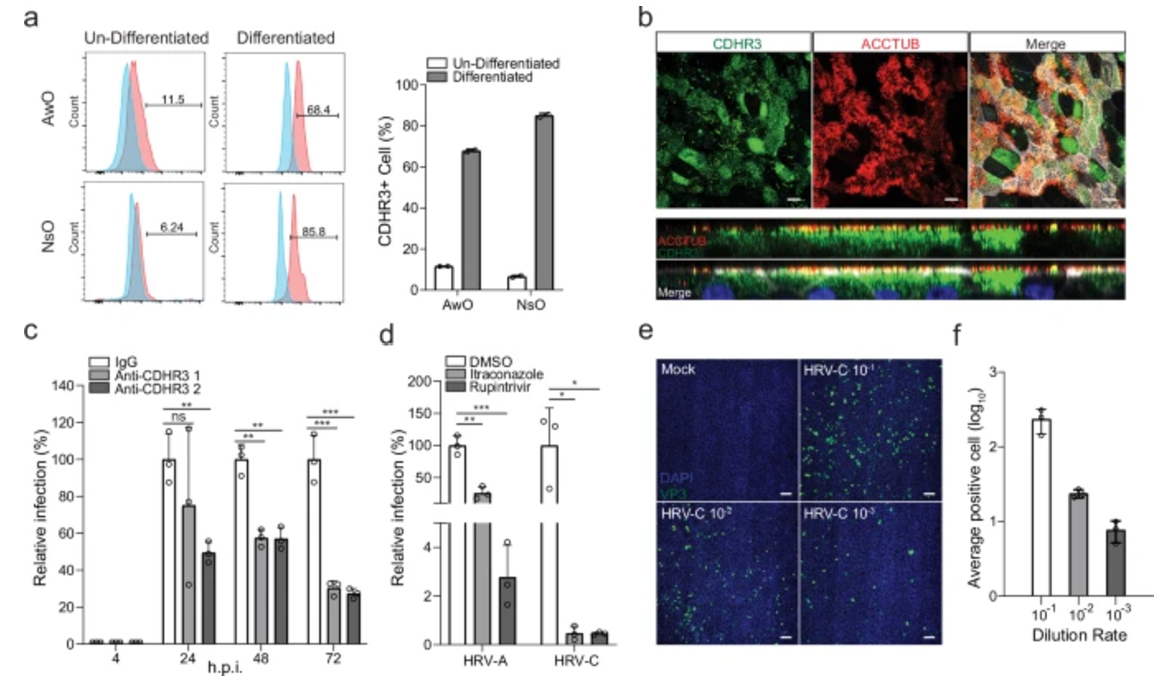
图4:气道和鼻类器官中的受体阻断、抗病毒抑制和病毒滴定
综上所述,本次研究成功地建立了能够稳定培养HRV-C的类器官系统,这一突破性成果填补了该领域长期以来的空白,为深入研究HRV-C开辟了一条全新的道路。通过对气道类器官和鼻类器官的全方位研究,系统地揭示了HRV-C感染过程中的病毒-宿主相互作用机制,从病毒的入侵、复制到宿主的免疫反应,都有了更为清晰的认识。这不仅为后续的抗病毒药物研发提供了坚实的理论基础和丰富的实验数据,也为疾病的防治策略制定提供了重要的参考依据。
更为重要的是,这一研究成果为其他难以培养的病毒研究提供了宝贵的经验和借鉴,有望引发病毒学研究领域的连锁反应,推动整个领域朝着更加深入、全面的方向发展,为守护人类健康带来新的希望和曙光。在未来的研究中,相信基于类器官的研究平台将不断拓展和完善,助力科研人员在病毒学的未知领域中不断探索,取得更多突破性的成果,为全球公共卫生事业做出更大的贡献。(生物谷Bioon.com)
参考文献:
Li C, Yu Y, Wan Z, et al. Human respiratory organoids sustained reproducible propagation of human rhinovirus C and elucidation of virus-host interaction. Nat Commun. 2024;15(1):10772. Published 2024 Dec 30. doi:10.1038/s41467-024-55076-2
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


