NEJM:中国3CL抗新冠创新药双盲临床研究首次登顶!
来源:奇点糕 2024-01-21 17:27
中国创新药——先诺欣®Ⅱ/Ⅲ期临床研究结果为大众提供了治疗COVID-19的新希望
由中国医学科学院、国家呼吸医学中心王辰院士和中日友好医院副院长曹彬教授牵头的先诺欣®Ⅱ/Ⅲ期临床研究,在全球顶级医学期刊《新英格兰医学杂志》(NEJM)发表,证明由先声药业与中国科学院上海药物研究所、中国科学院武汉病毒研究所联合研发的3CL口服抗新冠创新药先诺欣®(先诺特韦片/利托那韦片组合包装)安全有效[1]。
据了解,这是NEJM发表的首个采用安慰剂对照的中国自主研发新冠创新药临床试验,也是首次在优效性试验中证实抗病毒药物对轻中度新冠患者有效。这在新冠疫情常态化、新毒株仍不断出现的当下意义重大[2]。

先诺欣®安全性和有效性获国际医学界权威认证
先诺欣®的抗新冠病毒活性成分为先诺特韦,是一种口服小分子。与辉瑞Paxlovid(奈玛特韦/利托那韦组合包装)中的奈玛特韦一样,先诺特韦的作用靶点也是新冠病毒的3CL 蛋白酶(3CLpro,又称主蛋白酶Mpro)。
从作用机制上来讲,新冠病毒进入人体细胞之后,会释放RNA,这条RNA借助人体细胞的细胞器翻译出病毒多肽(pp1a和pp1ab),这些多肽在3CLpro等蛋白酶的作用下被水解成非结构蛋白(Nsps),随后由Nsps组成RNA复制酶(RdRP)[3]。不难看出,一旦3CLpro的活性被抑制,新冠病毒的复制就会中断。
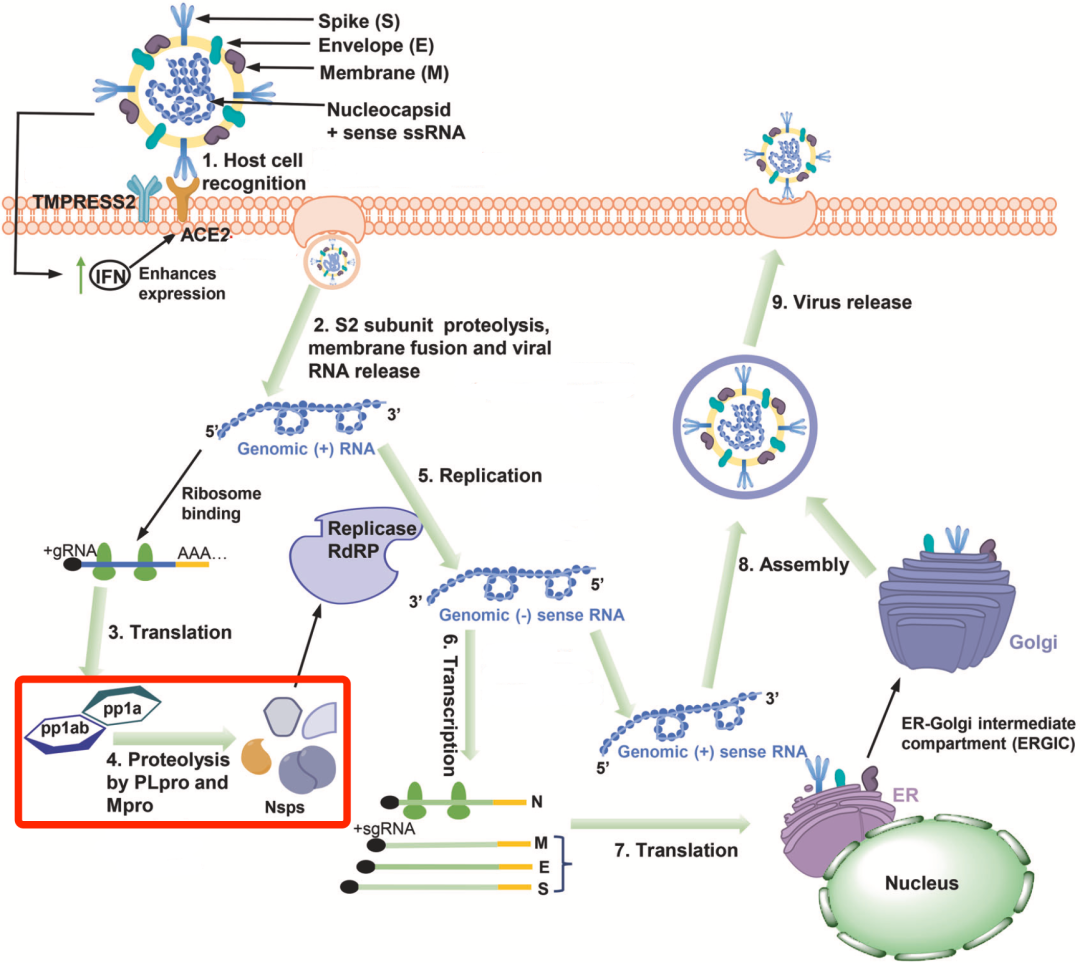
新冠病毒的复制过程[3]
由于先诺特韦在临床前和早期临床研究中表现出良好的抗病毒活性和临床治疗潜力,为了进一步评估先诺特韦的临床治疗效果和安全性,研究人员发起了这项多中心、双盲、随机、安慰剂对照Ⅱ/Ⅲ期临床研究(NCT05506176)。
在2022年8月19日至2022年12月16日间,研究人员在中国的35个临床研究中心招募了1208名在门诊就诊的轻度至中度新型冠状病毒感染(COVID-19)成年患者。这些患者年满18岁、COVID-19症状发作时间不超过3天、且在随机分组当天至少有一种COVID-19症状。值得注意的是,在入组患者中超过一半(53.5%)的患者至少有一种重症COVID-19的风险因素。
参与研究的所有受试者按1:1被随机分成两组,一组接受先诺欣®治疗(603人,750mg先诺特韦+100mg利托那韦),另一组接受安慰剂治疗(605人)。所有患者每天服药2次,连续服药5天。
值得关注的是,该研究的主要终点为全球首创。众所周知,在新冠病毒持续进化、疫苗接种覆盖率持续增加等因素的影响下,COVID-19患者重症率迅速降低。因此,如何评估药物的疗效成为一个国际性难题。在该研究中,我国研究人员创新性选用首次给药至11种目标COVID-19症状持续恢复2天的时间作为主要终点,该研究也是全球首个采用该终点作为评估轻中度新冠患者治疗结局的研究,结果证明了该疗效终点的可靠性。
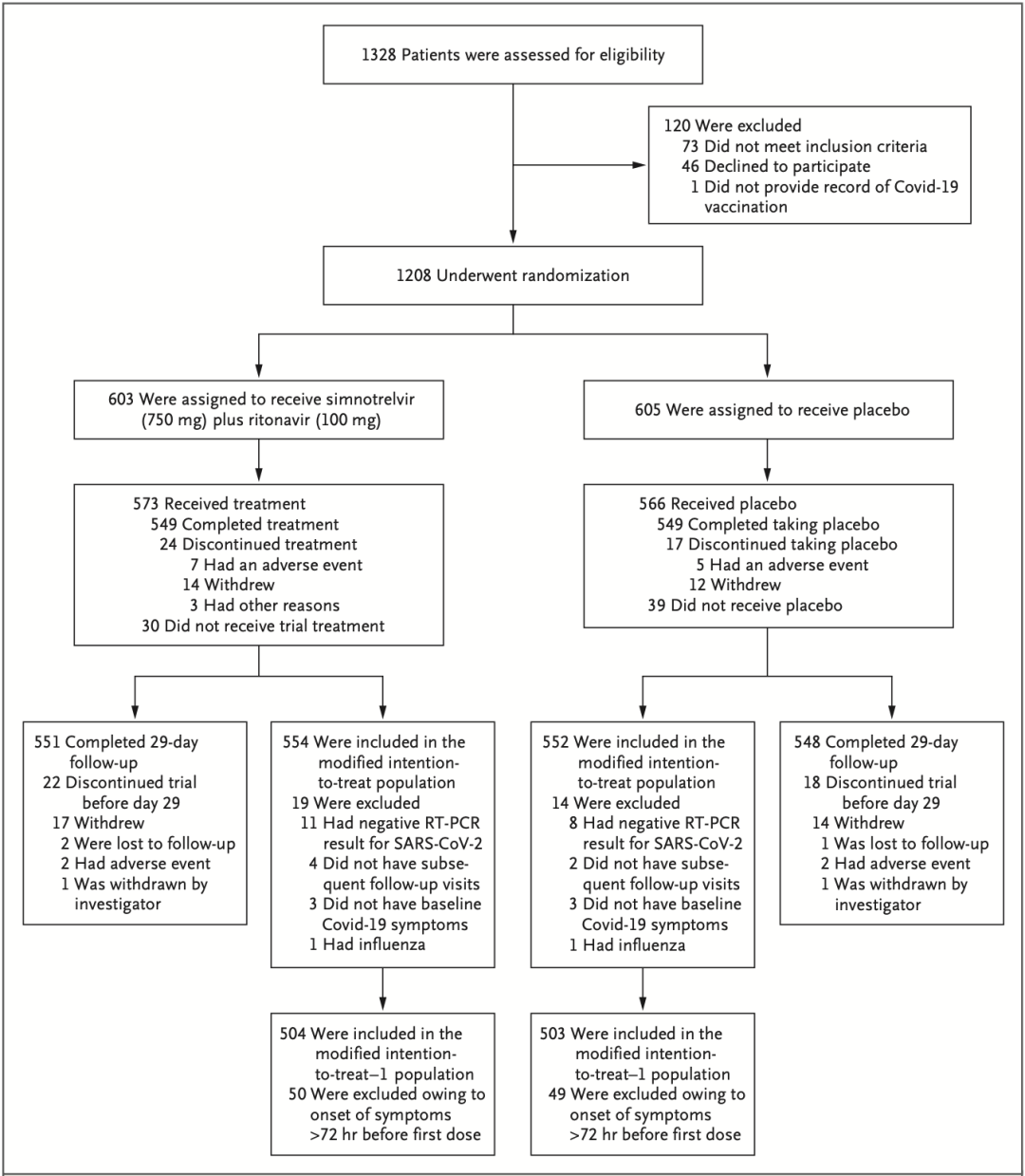
研究流程图
最终,有1007名患者在症状出现后3天内接受了治疗。从治疗效果来看,先诺欣®治疗组患者症状持续缓解的中位时间是180.1小时(7.5天),安慰剂治疗组的这一时间为216.0小时(9天),二者相差35.8小时。先诺欣®治疗组显著优于安慰剂组(P=0.006)。
简单来说,对于轻至中度COVID-19患者而言,在出现症状3天内口服先诺欣®,可带来中位1.5天提前恢复正常的治疗获益。值得注意的是,对于有重症风险因素的患者而言,先诺欣®治疗组恢复的时间缩短达60.4个小时(2.5天),有重症风险因素人群能从先诺欣®治疗中获得更大的益处。此外,先诺欣®还将呼吸道症状的缓解时间缩短了41.4小时(1.7天)。
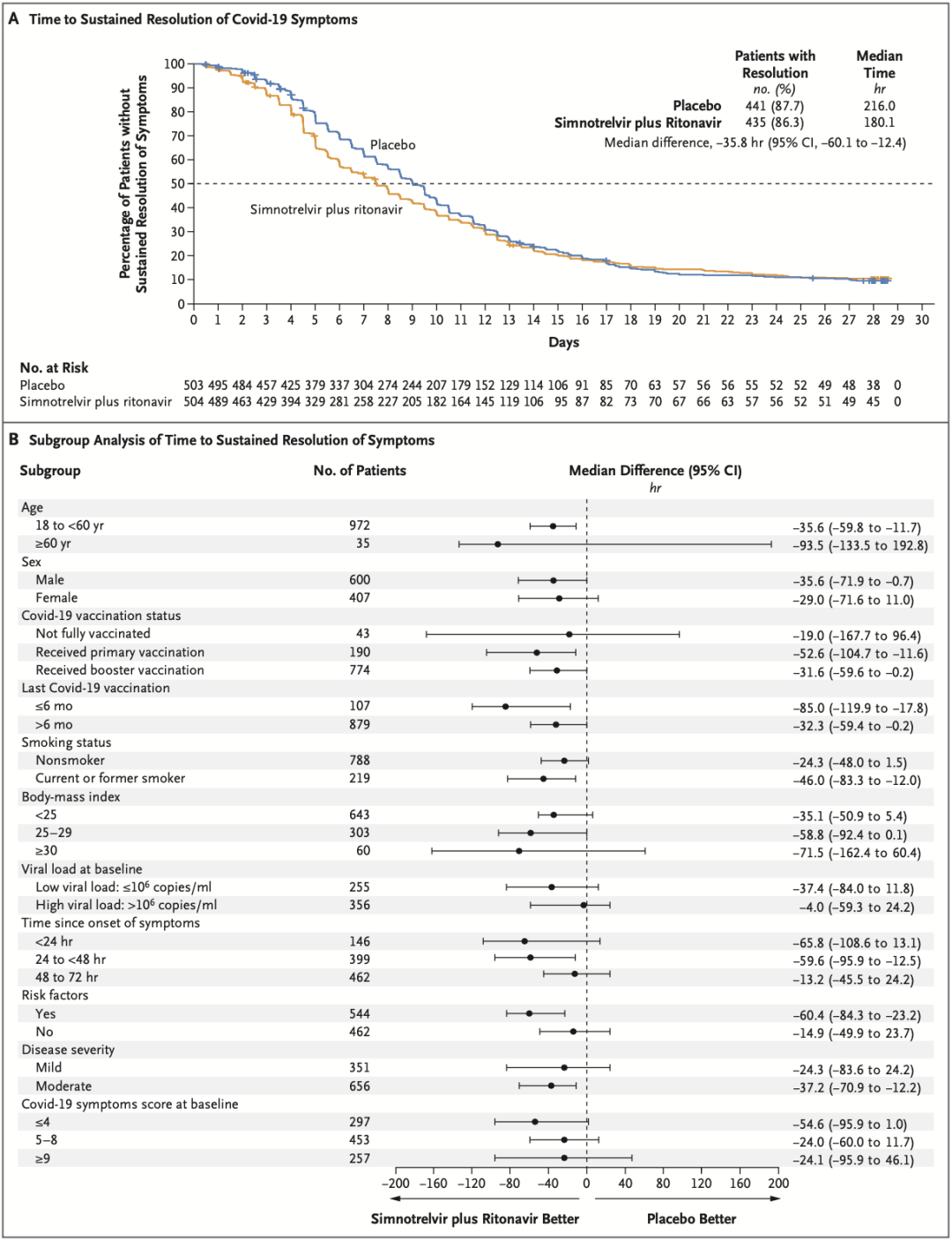
疗效数据
从抗病毒效果来看,在基线病毒载量相同的情况下,先诺欣®治疗组患者的病毒载量在治疗的第3天大幅下降,且下降幅度大于安慰剂治疗组;在治疗的第5天病毒载量降幅达到最大值,先诺欣®治疗组患者病毒载量比安慰剂组降低了96.9%(-1.51 log10 拷贝/mL)。更快的病毒载量下降以及呼吸道症状缓解,不仅可以降低新冠病毒的传播风险,还可以缓解病毒复制对患者身体造成的损伤。
这些数据说明,先诺欣®在人体内有较强的抗病毒能力。
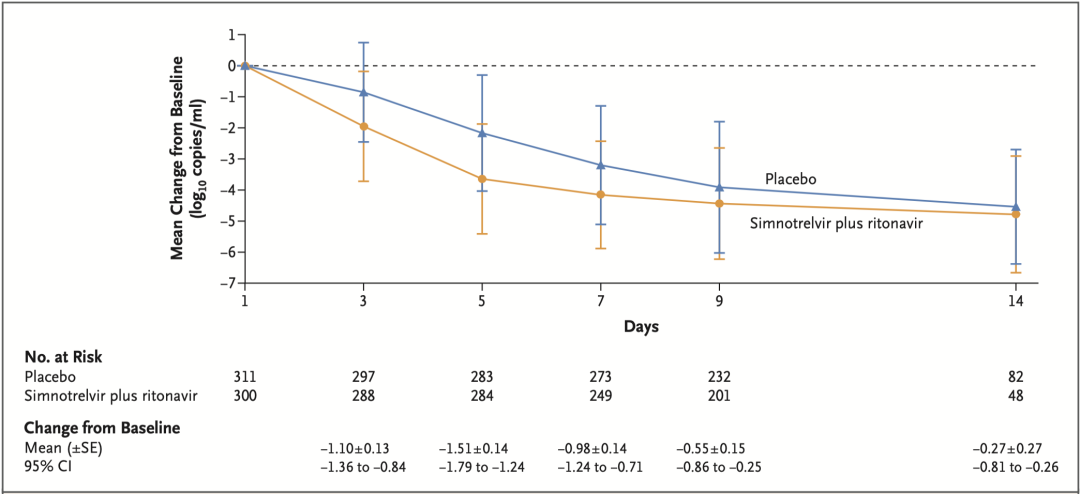
病毒载量随治疗时间的变化
在安全性方面,在整个治疗期间,先诺欣®治疗组的不良事件发生率略高于安慰剂组(29.0% vs 21.6%),但大多为1级或2级,无需药物干预即可自行好转,且期间未发生严重不良事件。这些数据表明,先诺欣®整体安全性良好。
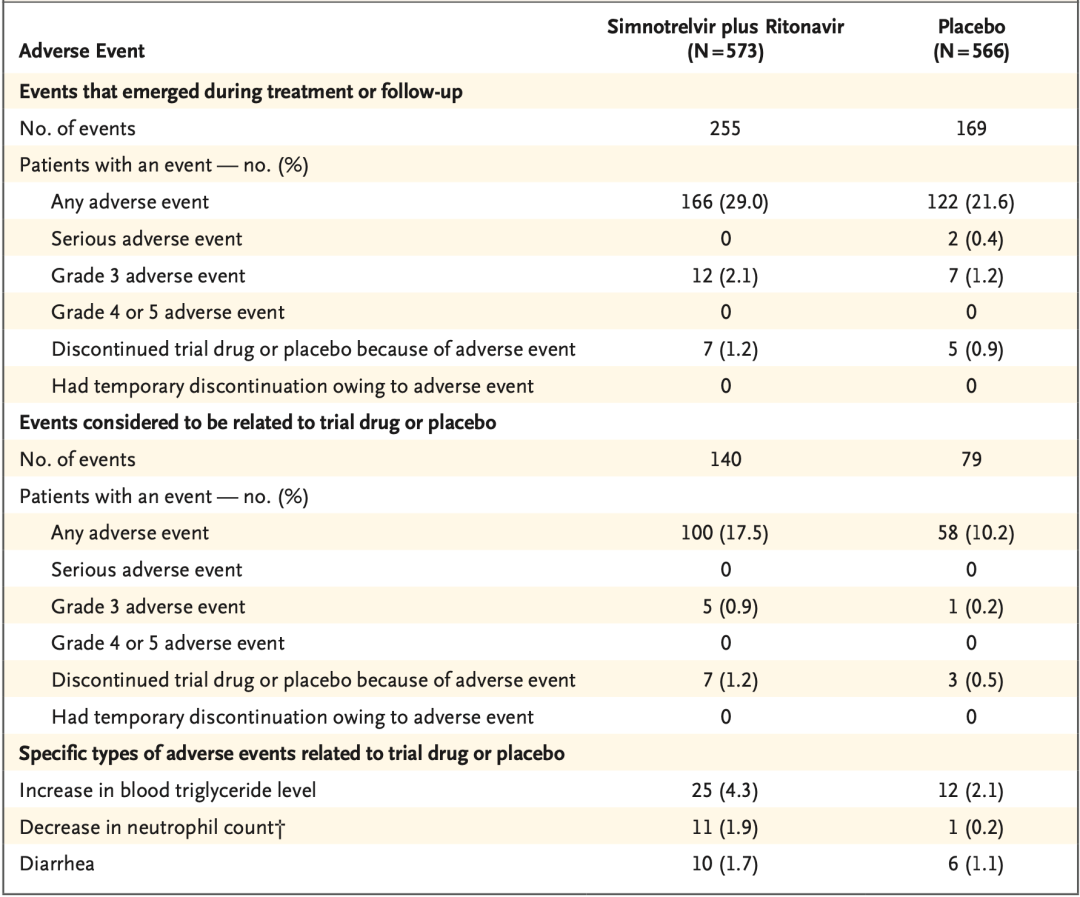
安全性数据
需要指出的是,在谈及抗新冠药物的安全性时,很多人容易将它与药物相互作用混淆。与Paxlovid一样,先诺欣®也包含利托那韦。众所周知,利托那韦是CYP3A酶抑制剂,而临床中一些药物是通过CYP3A酶代谢的。
因此,在临床用药中,有些药物不能与含利托那韦的治疗方案同时使用,或者需要调整使用剂量。对于这个问题,如果没有使用与利托那韦存在相互作用关系的药物,患者在治疗过程中遵循医嘱用药即可。
先诺欣®成为首个具备完整证据链的国产3CL抗新冠药
先诺欣®的优异临床研究数据之所以能登顶NEJM,与它扎实的临床前和早期临床研究密不可分。
1、临床前研究
早在新冠疫情爆发之初,上海药物研究所就组建了抗疫攻坚团队,联合武汉病毒研究所开展抗新冠病毒感染治疗药物的应急研发工作。最终在先声药业与中国科学院上海药物研究所、武汉病毒研究所的共同努力下,中国首款自主研发、具备自主知识产权的3CLpro靶点抗新冠病毒药诞生[4]。
2023年10月13日,先诺欣®临床前研究结果在国际知名期刊《自然·通讯》发表。研究结果表明,先诺特韦能选择性地抑制新冠病毒的3CLpro活性;在与利托那韦联用的情况下,可有效抑制病毒在小鼠的肺部和脑部复制,减轻病毒感染引起的组织损伤;在安全性评价实验中,也未发现心血管、遗传学和生殖毒性[5]。

2、Ⅰ期临床研究
在上述临床前研究的基础上,山东第一医科大学第一附属医院的研究人员招募了健康受试者,开展了Ⅰ期临床研究。
研究结果显示,先诺特韦具有足够的安全性和耐受性,并明确了先诺特韦/利托那韦的给药剂量为750mg/100mg,每日2次服用[6]。

作为第一个评估先诺特韦安全性和耐受性的临床试验,该研究证实了先诺特韦在健康成人受试者中具有良好的安全性和药代动力学特征,并为后续临床研究明确了药物使用剂量。相关研究成果于2023年9月30日在《欧洲药物科学杂志》发表。
3、Ⅰb期临床研究
基于临床前、Ⅰ期临床研究数据,2022年5月12日至8月29日,深圳市第三人民医院的研究人员招募了32名无症状、轻度或中度COVID-19成年感染者,开启了Ⅰb期临床研究。
研究结果显示,与安慰剂组相比,接受先诺特韦/利托那韦(750mg/100mg)治疗的感染者病毒载量大幅下降,COVID-19症状持续缓解所需时间大幅缩短,且患者对药物治疗的耐受性良好,所有不良事件均为1级[7]。

这一研究成果初步证明,先诺特韦/利托那韦治疗COVID-19安全有效,不仅能快速降低病毒载量,还能在更短时间内改善患者症状。此外,该研究进一步明确,750mg先诺特韦+100mg利托那韦为后续大型临床研究的推荐剂量。相关研究结果于2023年7月11日发表在《柳叶刀-区域健康(西太平洋)》。
“不积跬步,无以至千里”。前期扎实的研究数据,为Ⅱ/Ⅲ期临床研究的成功打下了坚实基础。
中国医学科学院、国家呼吸医学中心王辰院士表示:“在抗新冠药物中,3CL药物居主流位置。国产3CL药物在有效性、安全性方面有科学的理论基础和扎实的临床循证依据。先诺欣®II/III期临床研究在《新英格兰医学杂志》的发表,显示国际医药学界对国产3CL口服小分子抗新冠创新药的高度认同。该药的研发和对其有效性及安全性的科学评价为应对新冠病毒感染提供了有力支撑。”
呼吸病学国家重点学科呼吸感染领域带头人、中日友好医院副院长曹彬教授表示:“先诺特韦在降低病毒载量、缩短病程方面效果显著,尤其可为高风险人群带来更好获益。建议感染新冠后及早进行口服抗病毒治疗。”
上海华山医院感染科主任张文宏教授在《NEJM医学前沿》特邀点评中指出[2],该研究采用了创新性的研究终点,"展现了如何破局缺乏新冠抗病毒药物临床试验疗效评价标准难题的智慧,让我们看到中国研究者创造性解决国际公认难题的成功案例。随着我国创新药物的发展,我们今后必然会面临更多类似的需要突破的临床试验设计难题。"
国际顶尖学术期刊《自然》发文表示,先诺欣®Ⅱ/Ⅲ期临床研究结果为大众提供了治疗COVID-19的新希望[8]。
先诺欣®已被正式纳入医保目录
实际上,早在2023年1月28日,国家药监局就附条件批准先诺欣®用于治疗轻中度COVID-19成年患者[9]。仅一个月之后,国家卫生健康委便下发通知,将先诺欣®纳入《新型冠状病毒感染诊疗方案(试行第十版)》[10]。
同年6月,《免疫缺陷人群新型冠状病毒感染诊治策略中国专家共识(2023版)》将先诺欣®列为免疫缺陷人群国产小分子抗新冠病毒药物首选[11]。
值得一提的是,在2023年9月份,广东省药学会发布《COVID-19小分子抗病毒药物评价与遴选专家共识》,来自各大医院的近50位医学专家和药学专家,从药学特性、有效性、安全性、经济性和其他属性五个方面对六款国内上市的抗新冠药进行评分,先诺欣®以总分70.1分位列国产COVID-19小分子抗病毒药物第一名[12]。
2023年12月13日,先诺欣®被正式纳入2023年国家医保药品目录,每盒/疗程价格降至479元,价格仅为同靶点进口药物的四分之一。据了解,先诺欣®已覆盖全国31个省市自治区,306个城市及近3000家医疗机构。
中国创新药在崛起
总的来说,先诺欣®Ⅱ/Ⅲ期临床研究数据登顶NEJM,不仅证明了先诺欣®的疗效、安全性优异,并与其他登上NEJM的中国创新药研究一起证明中国创新药正在崛起,为解决国际公认难题展现出中国智慧和中国方案。
从先诺欣®的研发角度来看,创新性的研究院所+药企合作方式,让我国在自研3CL靶点抗新冠病毒药物上实现了“零的突破”。而在临床试验中提出全新的疗效评价标准,并得到国际同行的认可,这又为国际公认的抗新冠药物临床试验设计难题,提供了创新性解决方案。
据统计,在过去一年里,中国药企在肿瘤、抗新冠、细胞创新疗法等领域的创新药,至少先后4次登上顶级期刊NEJM,这说明包括先声药业在内的中国生物医药产业正处于高速创新期。
无论如何,希望在新冠疫情常态化、新的变异株不断涌现的当下,先诺欣®能为新冠病毒感染提供安全、有效、便捷的治疗方案;也期待中国药企在创新药物的研发上更上一层楼。
参考文献:
[1].Cao B, Wang Y, Lu H, et al. Oral Simnotrelvir for Adult Patients with Mild-to-Moderate Covid-19. N Engl J Med. 2024;390(3):230-241. doi:10.1056/NEJMoa2301425
[2].https://mp.weixin.qq.com/s/pU89vcYf2Yj4JF0mR8tFIg
[3].Yan W, Zheng Y, Zeng X, He B, Cheng W. Structural biology of SARS-CoV-2: open the door for novel therapies. Signal Transduct Target Ther. 2022;7(1):26. doi:10.1038/s41392-022-00884-5
[4].http://www.simm.cas.cn/web/xwzx/ttxw/202301/t20230130_6602899.html
[5].Jiang X, Su H, Shang W, et al. Structure-based development and preclinical evaluation of the SARS-CoV-2 3C-like protease inhibitor simnotrelvir. Nat Commun. 2023;14(1):6463. doi:10.1038/s41467-023-42102-y
[6].Yang XM, Yang Y, Yao BF, et al. A first-in-human phase 1 study of simnotrelvir, a 3CL-like protease inhibitor for treatment of COVID-19, in healthy adult subjects. Eur J Pharm Sci. 2023;191:106598. doi:10.1016/j.ejps.2023.106598
[7].Wang F, Xiao W, Tang Y, et al. Efficacy and safety of SIM0417 (SSD8432) plus ritonavir for COVID-19 treatment: a randomised, double-blind, placebo-controlled, phase 1b trial. Lancet Reg Health West Pac. 2023;38:100835. doi:10.1016/j.lanwpc.2023.100835
[8].Sidik S. Potent new pill provides COVID relief for the masses. Nature. Published online January 17, 2024. doi:10.1038/d41586-024-00117-5
[9].https://www.nmpa.gov.cn/yaowen/ypjgyw/ypyw/20230129143814163.html
[10].http://www.nhc.gov.cn/ylyjs/pqt/202303/b6e92218a52f458eb410123b53e1b2fe.shtml
[11].广州医科大学附属第一医院广州呼吸健康研究院,等. 免疫缺陷人群新型冠状病毒感染诊治策略中国专家共识(2023版). 中华传染病杂志,2023,41(6):367-377. doi:10.3760/cma.j.cn311365-20230202-00032.
[12].http://www.sinopharmacy.com.cn/uploads/file1/20230919/6509732fed6cd.pdf
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


