Science全文编译!我国科学家从结构上揭示一种强效的治疗性抗体中和SARS-CoV-2和SARS-CoV机制
来源:本站原创 2020-07-26 23:46
2020年7月26日讯/生物谷BIOON/---据世界卫生组织(WHO)的统计,截至2020年6月8日,2019年冠状病毒病(COVID-19)大流行已影响200多个国家/地区的700多万人,造成40万人死亡。这次大流行的病原体是一种新出现的冠状病毒:SARS-CoV-2,它与密切相关的SARS-CoV同属于冠状病毒科β冠状病毒属B谱系。位于SARS-CoV
2020年7月26日讯/生物谷BIOON/---据世界卫生组织(WHO)统计,截至2020年6月8日,2019年冠状病毒病(COVID-19)大流行已导致200多个国家/地区的700多万感染,并造成40万人死亡。导致这次大流行的病原体是一种新出现的冠状病毒:SARS-CoV-2,它与密切相关的SARS-CoV同属于冠状病毒科β冠状病毒属B谱系。位于SARS-CoV-2和SARS-CoV包膜的刺突糖蛋白(S)具有大约80%的氨基酸序列一致性,而且这两种病毒均利用人血管紧张素转化酶2(hACE2)进入宿主细胞。细胞进入是通过S蛋白同源三聚体介导的病毒-受体结合实现的,然后是病毒-宿主膜融合,其中这种结合是通过S蛋白的受体结合结构域(RBD)进行的。破坏S蛋白在感染建立中所发挥的这一关键作用是中和抗体的主要目标,也是治疗性干预和疫苗设计的重点。
之前表征的几种SARS-CoV中和抗体(NAb)被证明对SARS-CoV-2的中和活性非常有限。在这些中和抗体中,CR3022是一种针对SARS-CoV的弱中和抗体,虽然可以紧密结合SARS-CoV-2,但对后者无中和作用,这表明中和表位可能存在构象差异。近期的研究报道了两种SARS-CoV中和抗体47D11和S309也被发现可以中和SARS-CoV-2,这提示着β冠状病毒属B谱系内存在广泛的交叉中和表位。含有SARS-CoV-2中和抗体的恢复期血浆已被发现可以为COVID-19患者提供明确的保护,然而科学家们对SARS-CoV-2的免疫原性特征和关键表位的了解还存在差距,这阻碍了为这种病毒开发有效的免疫疗法。
SARS-CoV和SARS-CoV-2的RBD具有大约75%的氨基酸序列一致性,因此有可能发现靶向RBD的交叉中和抗体。在一项新的研究中,来自中国科学院、中国科学院大学、中国军事医学科学院、中国食品药品检定研究院、中国医学科学院、北京协和医学院、北京神州细胞生物技术公司和北京义翘神州科技公司的研究人员通过使用噬菌体展示技术,构建出一个抗体库,该抗体库是从由用重组SARS-CoV RBD免疫的小鼠的外周淋巴细胞中提取的RNA产生的。利用SARS-CoV-2 RBD作为筛选噬菌体抗体库的靶点,寻找潜在的命中目标。将显示与SARS-CoV-2 RBD紧密结合的抗体作为嵌合抗体进行进一步优化,并使用基于水泡性口炎病毒(VSV)的假型病毒系统测试它们的中和活性。相关研究结果于2020年7月23日在线发表在Science期刊上,论文标题为“Structural basis for neutralization of SARS-CoV-2 and SARS-CoV by a potent therapeutic antibody”。
在测试的抗体中,对SARS-CoV-2假病毒具有强效中和活性的抗体克隆014进行人源化,并将它命名为H014。为了评估结合亲和力,利用OCTET系统监测H014与SARS-CoV-2 RBD或SARS-CoV RBD的实时结合和解离。H014 IgG和它的Fab片段均表现出与SARS-CoV-2 RBD和SARS-CoV RBD的紧密结合,与这两种RBD在亚nM水平上具有相当的结合亲和力(图1A)。
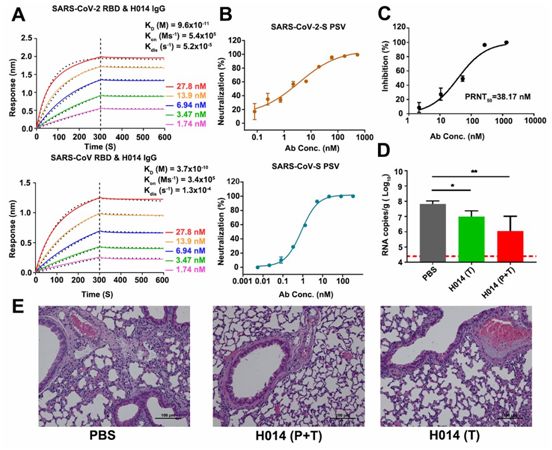
假病毒中和试验显示H014具有强效的中和活性:对SARS-CoV-2和SARS-CoV假病毒的50%中和浓度值(IC50)分别为3 nM和1 nM(图1B)。对真正的SARS-CoV-2毒株(BetaCoV/Beijing/AMMS01/2020)进行的斑块还原中和试验(plaque-reduction neutralization test, PRNT)验证了它的中和活性:它的IC50为38 nM,比在假型病毒系统中观察到的低10倍(图1C)。这些作者接下来试图评估H014在他们先前建立的hACE2人源化小鼠模型中的体内保护功效,其中这种小鼠模型对SARS-CoV-2感染敏感。
在这种小鼠模型中,由于hACE2在肺细胞表面上的表达,SARS-CoV-2进入肺部,并像在人体中一样复制,在感染5天后表现出肺部病变。hACE2人源化小鼠在5×105 PFU的SARS-CoV-2(BetaCoV/Beijing/AMMS01/2020)鼻内感染4小时后(1剂,治疗)或12小时前和4小时后(2剂,预防加治疗),腹腔注射50mg/kg的H014进行治疗。所有遭受病毒挑战的小鼠在第5天时被杀死。虽然PBS组(对照组)小鼠肺部的病毒载量在第5天飙升至约107 RNA拷贝/g(图1D),但是值得注意的是,在预防组和预防加治疗组小鼠中,H014治疗使得它们的肺部的病毒滴度在第5天分别降低了大约10倍和100倍(图1D)。肺部病理分析显示,SARS-CoV-2在磷酸盐缓冲液(PBS)处理后引起轻度间质性肺炎,其特点是炎性细胞浸润、肺泡间隔增厚和明显的血管系统损伤。相比之下,在接受H014治疗的小鼠的肺切片上未观察到明显的肺泡上皮细胞病变或局灶性出血(图1E),这表明H014在治疗COVID-19方面具有潜在的治疗作用。
SARS-CoV-2 S蛋白三聚体的整体结构与SARS-CoV和其他冠状病毒相似。S蛋白的每个单体由两个功能性亚基组成。S1亚基结合宿主细胞受体,而S2亚基介导病毒膜与宿主细胞膜的融合。S1亚基内的四个结构域包括N端结构域(NTD)、RBD和两个亚结构域(SD1和SD2),这两个亚结构域的位置与S1/S2的切割位点相邻。RBD的铰链样运动产生了两种不同的构象状态,称为“关闭”和“开放”,其中关闭状态对应于受体不可访问状态,开放状态对应于受体可访问的状态,这应该是是亚稳定的。
对稳定化的SARS-CoV-2 S蛋白的胞外结构域与H014 Fab片段形成的复合物的低温电镜(Cryo-EM)结构表征发现,这种复合物采用三种不同的构象状态,分别对应一个RBD开放+两个RBD关闭(状态1)、两个RBD开放+一个RBD关闭(状态2)和三个RBD全部开放(状态3)(图2A)。有趣的是,尽管存在过多的Fab,但是完全关闭(状态4)的SARS-CoV-2 S蛋白三聚体在没有任何Fab结合下的结构也在Cryo-EM数据的三维分类过程中观察到,这提示着H014的结合位点通过蛋白“呼吸”暴露,随后进行随机RBD运动(图2A)。这些作者在3.4~3.6 埃米的分辨率下对这4种状态的S蛋白进行不对称cryo-EM重建。然而,由于构象的异质性,RBD和H014之间的结合界面的电子势图相对较弱。为了解决这个问题,他们采用 “基于区块”的重建方法进行了聚焦分类和精细化处理,进一步提高了局部分辨率至3.9埃米,从而使得对相互作用模式的分析更为可靠。利用结合界面结构对H014和S蛋白之间的相互作用进行了详细分析。
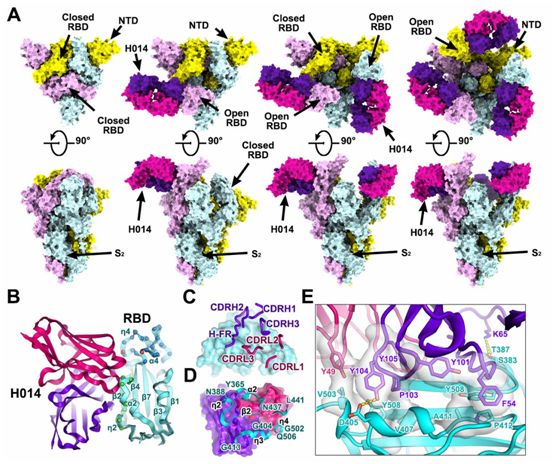
H014识别位于开放RBD一侧的构象表位,仅涉及蛋白/蛋白接触,这与受体结合基序(RBM)不同(图2B)。H014补位(paratope,即抗体决定簇)构成了所有六个互补决定性区(CDR)环(CDRL1-3和CDRH1-3)和不寻常的重链框架(HF-R,残基58-65),这就与RBD形成紧密的相互作用,从而产生了大约1000平方埃米的埋藏区域(图2C)。
H014轻链和重链的可变区通过疏水和亲水接触分别贡献了大约32%和68%的埋藏表面积。这个H014表位由21个残基组成,主要定位在α2-β2-η2 (残基368-386)、η3 (残基405-408、411-413)、α4(残基439)和η4(残基503)区域,从而在RBD的一侧形成了一个空腔(图2、B和D)。一个长12个氨基酸残基的CDRH3插入该空腔,富含疏水残基(YDPYYVM)的CDRH3与RBD的五股β-折叠(β2)区域的η3和边缘接触(图2D)。RBD和H014之间的紧密结合主要是由于由两个片块(patch)贡献的广泛的疏水相互作用,其中的一个片块是由来自CDRH2的F54、来自CDRH3的Y101和来自RBD的A411、P412和Y508形成的,另一个片块是由来自CDRL2的Y49、来自CDRH3的P103、Y104、Y105和来自RBD的V407、V503和Y508组成的(图2E)。此外,来自CDRH1和HF-R的亲水接触进一步增强了RBD-H014的相互作用,从而导致在25℃或37℃的温度下在亚nM水平上具有极高的结合亲和力(图2E)。构成该表位的残基大多是保守的,在目前报道的在人群中传播的SARS-CoV-2毒株中,这个区域出现3个单位点突变(R408I、N439K和V503F)。
另外,一些SARS-CoV-2分离株在RBD中携带一个共同的突变V367F,这个突变位于主要表位片块(epitope patch)α2-β2-η2附近。携带上述氨基酸残基点突变和其他已报道的替代突变的重组RBD构建物与H014的结合亲和力是难以区分的,这提示着H014可能对目前在全球范围内传播的SARS-CoV-2毒株具有广泛的中和活性。在这个H014表位的21个氨基酸残基中,SARS-CoV-2和SARS-CoV之间有17个残基(81%)是相同的,这解释了交叉反应性和相似的结合亲和力。
为了研究H014是否干扰SARS-CoV-2或SARS-CoV的RBD与hACE2的结合,这些作者在蛋白和细胞水平上进行了竞争性结合试验。酶联免疫吸附试验(ELISA)结果表明,H014能够与重组hACE2竞争性地结合SARS-CoV-2和SARS-CoV的RBD,EC50值分别为0.7 nM和5 nM(图3A)。此外,H014既能有效阻断SARS-CoV-2 RBD与表达ACE2的293T细胞的结合,又能阻断重组ACE2与表达SARS-CoV-2 S 蛋白的293T细胞的结合(图3B)。
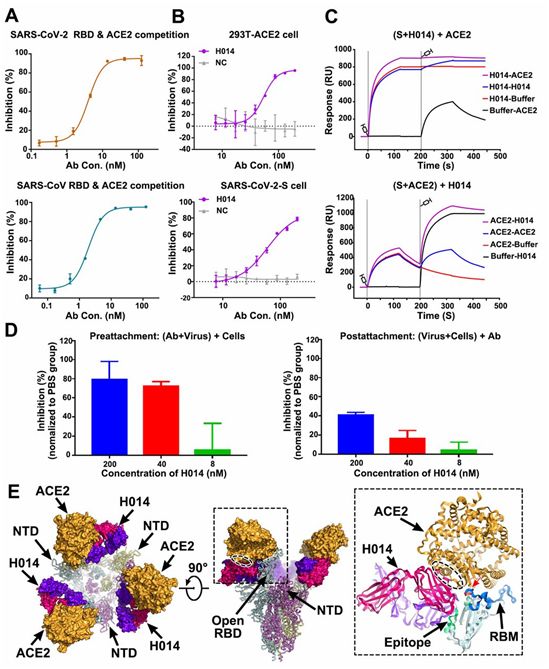
为了验证H014对S蛋白三聚体的潜在完全封闭,这些作者进行了两组表面等离子共振(SPR)测试,先将S蛋白三聚体暴露于H014,然后再暴露于hACE2,或者反过来。正如预期的那样,H014的结合完全阻断了hACE2对S蛋白三聚体的附着。再者,hACE2可以从S蛋白三聚体移出而被H014取代(图3C)。为了在一种基于细胞的病毒感染模型中进一步验证这些结果,他们进行了实时RT-PCR分析,以定量确定残留在4℃下在病毒附着之前或之后暴露于抗体中的宿主细胞表面上的病毒载量。
H014以剂量依赖的方式有效地阻止SARS-CoV-2附着到细胞表面上,而且已经结合到细胞表面上的病毒颗粒可以被H014部分释放下来(图3D)。将H014-SARS-CoV-2三聚体S蛋白复合物的结构与ACE2-SARS-CoV-2 RBD复合物的结构叠加在一起,可发现hACE2和H014之间发生冲突的原因位于RBD顶端螺旋(η4)的结合位点所属区域存在重叠(图3E)。这一观察结果与大多数已知的SARS-CoV RBD-靶向抗体复合物的观察结果大不相同,其中这些靶向抗体直接识别RBM。因此,H014阻止SARS-CoV-2附着于宿主细胞的能力可以归因于与hACE2之间存在立体冲突。
类似于RBM的是,这个H014表位只能在开放状态下访问,这表明它存在这种类似于RBM的作用---涉及对与宿主细胞的相互作用的动态干扰。这些作者观察到的结构连同以前报道的冠状病毒S结构(不包括人类冠状病毒HKU1),已揭示了S1亚基的呼吸介导“关闭”和“开放”构象之间的过渡(图4A)。与大多数结构中观察到的RBD的铰链状运动不同的是,在这些作者的结构中观察到的从“关闭”到“开放”的构象转变主要涉及两个旋转步骤:1)SD1围绕铰链点(在氨基酸残基320处)逆时针旋转大约25°;2)RBD自身逆时针旋转大约60°(图4B)。SD1和RBD在近端位置的构象旋转会导致远端位置的变化放大,从而为H014或ACE2的结合开辟了足够的空间(图4B)。不明确的地方在于,在这些作者的复合物结构中观察到的特殊构象转变是H014参与的结果,还是SD1和RBD协同运动的结果。
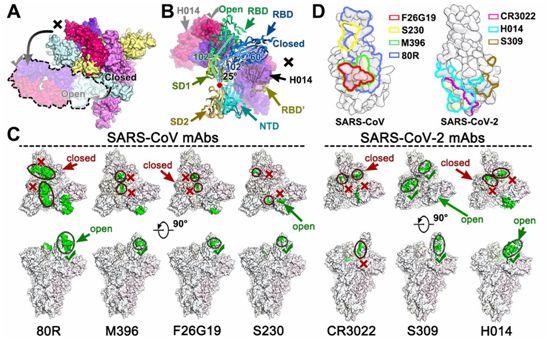
体液免疫对预防冠状病毒感染至关重要,而恢复期血浆的被动免疫已被证明对治疗SARS和COVID-19有效。人们之前已报道在RBD处于开放构象下,一些SARS-CoV特异性中和抗体,包括m396、80R和F26G19,主要结合RBM核心(SARS-CoV中的氨基酸残基484-492)(图4、C和D)。意外的是,到目前为止,这些抗体都没有对SARS-CoV-2表现出令人印象深刻的中和活性。作为一种在功能上模拟受体附着并促进膜融合的SARS-CoV中和抗体,S230尽管也需要RBD处于开放状态,但是它能识别位于RBM顶部的一个小片块(图4,C和D)。近期,另外两种抗体(CR3022和S309)源于2003年SARS幸存者的记忆B细胞,表现出与SARS-CoV-2的强效结合。令人吃惊的是,CR3022未能在体外中和SARS-CoV-2,这可能是由于CR3022结合了一个远离RBD的隐性表位,只有当至少两个RBD处于开放状态时才能进入这个表位。此外,CR3022不与hACE2竞争与RBD的结合(图4,C和D)。
相比之下,S309是最近报道的一种针对SARS-CoV和SARS-CoV-2的中和性mAb,它能识别一个在SARS-CoV和SARS-CoV-2 RBD的开放和关闭状态下均可访问的保守性含聚糖表位。S309的中和机制并不依赖于直接阻断受体结合,但是它能诱导抗体依赖性细胞毒性(ADCC)和抗体依赖性细胞吞噬作用(ADCP)。这些作者报道了一种强效的治疗性抗体H014,它可以通过阻断病毒与宿主细胞的结合来交叉中和SARS-CoV-2和SARS-CoV感染(图3)。与其他抗体不同的是,H014结合了RBD的一个完整侧面,从近端η2一直到RBM的远端边缘,并与m392、80R、F26G19、CR3022和S309等SARS-CoV特异性抗体具有部分重叠的表位(图4、C和D)。
虽然SARS-CoV和SARS-CoV-2都利用hACE2进入宿主细胞,但已观察到这两种病毒的RBM存在较高的序列变化和RBM远端发生局部构象重排。这很可能导致一些抗体,特别是靶向SARS-CoV RBM的抗体,在交叉结合和交叉中和SARS-CoV-2时遭遇失败。三种交叉反应性抗体(CR3022、S309和H014)能识别位于RBM之外的更多保守性表位,其中CR3022表位与RBM距离最远(图4、C和D),这提示着这可能是它不能中和SARS-CoV-2的原因。H014结合了更多的保守性表位,其中的一些表位与RBM很接近,从而使得它能有效地交叉中和B谱系冠状病毒。此外,识别RBM以外更多保守性片块的抗体将与靶向RBM的抗体协同作用以增强中和活性,从而可能降低病毒逃逸的风险。这项新研究中揭示的H014表位的分子特征有利于发现B谱系冠状病毒中的广泛交叉中和表位,并为基于结构的合理疫苗设计提供了令人关注的靶标。这些作者的研究结果也凸显了基于抗体的治疗性干预措施治疗COVID-19的前景。(生物谷 Bioon.com)
参考资料:
Zhe Lv et al. Structural basis for neutralization of SARS-CoV-2 and SARS-CoV by a potent therapeutic antibody. Science, 2020, doi:10.1126/science.abc5881.
之前表征的几种SARS-CoV中和抗体(NAb)被证明对SARS-CoV-2的中和活性非常有限。在这些中和抗体中,CR3022是一种针对SARS-CoV的弱中和抗体,虽然可以紧密结合SARS-CoV-2,但对后者无中和作用,这表明中和表位可能存在构象差异。近期的研究报道了两种SARS-CoV中和抗体47D11和S309也被发现可以中和SARS-CoV-2,这提示着β冠状病毒属B谱系内存在广泛的交叉中和表位。含有SARS-CoV-2中和抗体的恢复期血浆已被发现可以为COVID-19患者提供明确的保护,然而科学家们对SARS-CoV-2的免疫原性特征和关键表位的了解还存在差距,这阻碍了为这种病毒开发有效的免疫疗法。
SARS-CoV和SARS-CoV-2的RBD具有大约75%的氨基酸序列一致性,因此有可能发现靶向RBD的交叉中和抗体。在一项新的研究中,来自中国科学院、中国科学院大学、中国军事医学科学院、中国食品药品检定研究院、中国医学科学院、北京协和医学院、北京神州细胞生物技术公司和北京义翘神州科技公司的研究人员通过使用噬菌体展示技术,构建出一个抗体库,该抗体库是从由用重组SARS-CoV RBD免疫的小鼠的外周淋巴细胞中提取的RNA产生的。利用SARS-CoV-2 RBD作为筛选噬菌体抗体库的靶点,寻找潜在的命中目标。将显示与SARS-CoV-2 RBD紧密结合的抗体作为嵌合抗体进行进一步优化,并使用基于水泡性口炎病毒(VSV)的假型病毒系统测试它们的中和活性。相关研究结果于2020年7月23日在线发表在Science期刊上,论文标题为“Structural basis for neutralization of SARS-CoV-2 and SARS-CoV by a potent therapeutic antibody”。
在测试的抗体中,对SARS-CoV-2假病毒具有强效中和活性的抗体克隆014进行人源化,并将它命名为H014。为了评估结合亲和力,利用OCTET系统监测H014与SARS-CoV-2 RBD或SARS-CoV RBD的实时结合和解离。H014 IgG和它的Fab片段均表现出与SARS-CoV-2 RBD和SARS-CoV RBD的紧密结合,与这两种RBD在亚nM水平上具有相当的结合亲和力(图1A)。

图1.H014是一种具有治疗价值的B谱系冠状病毒交叉中和抗体,图片来自Science, 2020, doi:10.1126/science.abc5881。
假病毒中和试验显示H014具有强效的中和活性:对SARS-CoV-2和SARS-CoV假病毒的50%中和浓度值(IC50)分别为3 nM和1 nM(图1B)。对真正的SARS-CoV-2毒株(BetaCoV/Beijing/AMMS01/2020)进行的斑块还原中和试验(plaque-reduction neutralization test, PRNT)验证了它的中和活性:它的IC50为38 nM,比在假型病毒系统中观察到的低10倍(图1C)。这些作者接下来试图评估H014在他们先前建立的hACE2人源化小鼠模型中的体内保护功效,其中这种小鼠模型对SARS-CoV-2感染敏感。
在这种小鼠模型中,由于hACE2在肺细胞表面上的表达,SARS-CoV-2进入肺部,并像在人体中一样复制,在感染5天后表现出肺部病变。hACE2人源化小鼠在5×105 PFU的SARS-CoV-2(BetaCoV/Beijing/AMMS01/2020)鼻内感染4小时后(1剂,治疗)或12小时前和4小时后(2剂,预防加治疗),腹腔注射50mg/kg的H014进行治疗。所有遭受病毒挑战的小鼠在第5天时被杀死。虽然PBS组(对照组)小鼠肺部的病毒载量在第5天飙升至约107 RNA拷贝/g(图1D),但是值得注意的是,在预防组和预防加治疗组小鼠中,H014治疗使得它们的肺部的病毒滴度在第5天分别降低了大约10倍和100倍(图1D)。肺部病理分析显示,SARS-CoV-2在磷酸盐缓冲液(PBS)处理后引起轻度间质性肺炎,其特点是炎性细胞浸润、肺泡间隔增厚和明显的血管系统损伤。相比之下,在接受H014治疗的小鼠的肺切片上未观察到明显的肺泡上皮细胞病变或局灶性出血(图1E),这表明H014在治疗COVID-19方面具有潜在的治疗作用。
SARS-CoV-2 S蛋白三聚体的整体结构与SARS-CoV和其他冠状病毒相似。S蛋白的每个单体由两个功能性亚基组成。S1亚基结合宿主细胞受体,而S2亚基介导病毒膜与宿主细胞膜的融合。S1亚基内的四个结构域包括N端结构域(NTD)、RBD和两个亚结构域(SD1和SD2),这两个亚结构域的位置与S1/S2的切割位点相邻。RBD的铰链样运动产生了两种不同的构象状态,称为“关闭”和“开放”,其中关闭状态对应于受体不可访问状态,开放状态对应于受体可访问的状态,这应该是是亚稳定的。
对稳定化的SARS-CoV-2 S蛋白的胞外结构域与H014 Fab片段形成的复合物的低温电镜(Cryo-EM)结构表征发现,这种复合物采用三种不同的构象状态,分别对应一个RBD开放+两个RBD关闭(状态1)、两个RBD开放+一个RBD关闭(状态2)和三个RBD全部开放(状态3)(图2A)。有趣的是,尽管存在过多的Fab,但是完全关闭(状态4)的SARS-CoV-2 S蛋白三聚体在没有任何Fab结合下的结构也在Cryo-EM数据的三维分类过程中观察到,这提示着H014的结合位点通过蛋白“呼吸”暴露,随后进行随机RBD运动(图2A)。这些作者在3.4~3.6 埃米的分辨率下对这4种状态的S蛋白进行不对称cryo-EM重建。然而,由于构象的异质性,RBD和H014之间的结合界面的电子势图相对较弱。为了解决这个问题,他们采用 “基于区块”的重建方法进行了聚焦分类和精细化处理,进一步提高了局部分辨率至3.9埃米,从而使得对相互作用模式的分析更为可靠。利用结合界面结构对H014和S蛋白之间的相互作用进行了详细分析。

图2.SARS-CoV-2 S蛋白三聚体与H014形成的复合物的低温电镜(Cryo-EM)结构,图片来自Science, 2020, doi:10.1126/science.abc5881。
H014识别位于开放RBD一侧的构象表位,仅涉及蛋白/蛋白接触,这与受体结合基序(RBM)不同(图2B)。H014补位(paratope,即抗体决定簇)构成了所有六个互补决定性区(CDR)环(CDRL1-3和CDRH1-3)和不寻常的重链框架(HF-R,残基58-65),这就与RBD形成紧密的相互作用,从而产生了大约1000平方埃米的埋藏区域(图2C)。
H014轻链和重链的可变区通过疏水和亲水接触分别贡献了大约32%和68%的埋藏表面积。这个H014表位由21个残基组成,主要定位在α2-β2-η2 (残基368-386)、η3 (残基405-408、411-413)、α4(残基439)和η4(残基503)区域,从而在RBD的一侧形成了一个空腔(图2、B和D)。一个长12个氨基酸残基的CDRH3插入该空腔,富含疏水残基(YDPYYVM)的CDRH3与RBD的五股β-折叠(β2)区域的η3和边缘接触(图2D)。RBD和H014之间的紧密结合主要是由于由两个片块(patch)贡献的广泛的疏水相互作用,其中的一个片块是由来自CDRH2的F54、来自CDRH3的Y101和来自RBD的A411、P412和Y508形成的,另一个片块是由来自CDRL2的Y49、来自CDRH3的P103、Y104、Y105和来自RBD的V407、V503和Y508组成的(图2E)。此外,来自CDRH1和HF-R的亲水接触进一步增强了RBD-H014的相互作用,从而导致在25℃或37℃的温度下在亚nM水平上具有极高的结合亲和力(图2E)。构成该表位的残基大多是保守的,在目前报道的在人群中传播的SARS-CoV-2毒株中,这个区域出现3个单位点突变(R408I、N439K和V503F)。
另外,一些SARS-CoV-2分离株在RBD中携带一个共同的突变V367F,这个突变位于主要表位片块(epitope patch)α2-β2-η2附近。携带上述氨基酸残基点突变和其他已报道的替代突变的重组RBD构建物与H014的结合亲和力是难以区分的,这提示着H014可能对目前在全球范围内传播的SARS-CoV-2毒株具有广泛的中和活性。在这个H014表位的21个氨基酸残基中,SARS-CoV-2和SARS-CoV之间有17个残基(81%)是相同的,这解释了交叉反应性和相似的结合亲和力。
为了研究H014是否干扰SARS-CoV-2或SARS-CoV的RBD与hACE2的结合,这些作者在蛋白和细胞水平上进行了竞争性结合试验。酶联免疫吸附试验(ELISA)结果表明,H014能够与重组hACE2竞争性地结合SARS-CoV-2和SARS-CoV的RBD,EC50值分别为0.7 nM和5 nM(图3A)。此外,H014既能有效阻断SARS-CoV-2 RBD与表达ACE2的293T细胞的结合,又能阻断重组ACE2与表达SARS-CoV-2 S 蛋白的293T细胞的结合(图3B)。

图3.H014的中和机制,图片来自Science, 2020, doi:10.1126/science.abc5881。
为了验证H014对S蛋白三聚体的潜在完全封闭,这些作者进行了两组表面等离子共振(SPR)测试,先将S蛋白三聚体暴露于H014,然后再暴露于hACE2,或者反过来。正如预期的那样,H014的结合完全阻断了hACE2对S蛋白三聚体的附着。再者,hACE2可以从S蛋白三聚体移出而被H014取代(图3C)。为了在一种基于细胞的病毒感染模型中进一步验证这些结果,他们进行了实时RT-PCR分析,以定量确定残留在4℃下在病毒附着之前或之后暴露于抗体中的宿主细胞表面上的病毒载量。
H014以剂量依赖的方式有效地阻止SARS-CoV-2附着到细胞表面上,而且已经结合到细胞表面上的病毒颗粒可以被H014部分释放下来(图3D)。将H014-SARS-CoV-2三聚体S蛋白复合物的结构与ACE2-SARS-CoV-2 RBD复合物的结构叠加在一起,可发现hACE2和H014之间发生冲突的原因位于RBD顶端螺旋(η4)的结合位点所属区域存在重叠(图3E)。这一观察结果与大多数已知的SARS-CoV RBD-靶向抗体复合物的观察结果大不相同,其中这些靶向抗体直接识别RBM。因此,H014阻止SARS-CoV-2附着于宿主细胞的能力可以归因于与hACE2之间存在立体冲突。
类似于RBM的是,这个H014表位只能在开放状态下访问,这表明它存在这种类似于RBM的作用---涉及对与宿主细胞的相互作用的动态干扰。这些作者观察到的结构连同以前报道的冠状病毒S结构(不包括人类冠状病毒HKU1),已揭示了S1亚基的呼吸介导“关闭”和“开放”构象之间的过渡(图4A)。与大多数结构中观察到的RBD的铰链状运动不同的是,在这些作者的结构中观察到的从“关闭”到“开放”的构象转变主要涉及两个旋转步骤:1)SD1围绕铰链点(在氨基酸残基320处)逆时针旋转大约25°;2)RBD自身逆时针旋转大约60°(图4B)。SD1和RBD在近端位置的构象旋转会导致远端位置的变化放大,从而为H014或ACE2的结合开辟了足够的空间(图4B)。不明确的地方在于,在这些作者的复合物结构中观察到的特殊构象转变是H014参与的结果,还是SD1和RBD协同运动的结果。

图4.S1亚基的呼吸和中和抗体的表位,图片来自Science, 2020, doi:10.1126/science.abc5881。
体液免疫对预防冠状病毒感染至关重要,而恢复期血浆的被动免疫已被证明对治疗SARS和COVID-19有效。人们之前已报道在RBD处于开放构象下,一些SARS-CoV特异性中和抗体,包括m396、80R和F26G19,主要结合RBM核心(SARS-CoV中的氨基酸残基484-492)(图4、C和D)。意外的是,到目前为止,这些抗体都没有对SARS-CoV-2表现出令人印象深刻的中和活性。作为一种在功能上模拟受体附着并促进膜融合的SARS-CoV中和抗体,S230尽管也需要RBD处于开放状态,但是它能识别位于RBM顶部的一个小片块(图4,C和D)。近期,另外两种抗体(CR3022和S309)源于2003年SARS幸存者的记忆B细胞,表现出与SARS-CoV-2的强效结合。令人吃惊的是,CR3022未能在体外中和SARS-CoV-2,这可能是由于CR3022结合了一个远离RBD的隐性表位,只有当至少两个RBD处于开放状态时才能进入这个表位。此外,CR3022不与hACE2竞争与RBD的结合(图4,C和D)。
相比之下,S309是最近报道的一种针对SARS-CoV和SARS-CoV-2的中和性mAb,它能识别一个在SARS-CoV和SARS-CoV-2 RBD的开放和关闭状态下均可访问的保守性含聚糖表位。S309的中和机制并不依赖于直接阻断受体结合,但是它能诱导抗体依赖性细胞毒性(ADCC)和抗体依赖性细胞吞噬作用(ADCP)。这些作者报道了一种强效的治疗性抗体H014,它可以通过阻断病毒与宿主细胞的结合来交叉中和SARS-CoV-2和SARS-CoV感染(图3)。与其他抗体不同的是,H014结合了RBD的一个完整侧面,从近端η2一直到RBM的远端边缘,并与m392、80R、F26G19、CR3022和S309等SARS-CoV特异性抗体具有部分重叠的表位(图4、C和D)。
虽然SARS-CoV和SARS-CoV-2都利用hACE2进入宿主细胞,但已观察到这两种病毒的RBM存在较高的序列变化和RBM远端发生局部构象重排。这很可能导致一些抗体,特别是靶向SARS-CoV RBM的抗体,在交叉结合和交叉中和SARS-CoV-2时遭遇失败。三种交叉反应性抗体(CR3022、S309和H014)能识别位于RBM之外的更多保守性表位,其中CR3022表位与RBM距离最远(图4、C和D),这提示着这可能是它不能中和SARS-CoV-2的原因。H014结合了更多的保守性表位,其中的一些表位与RBM很接近,从而使得它能有效地交叉中和B谱系冠状病毒。此外,识别RBM以外更多保守性片块的抗体将与靶向RBM的抗体协同作用以增强中和活性,从而可能降低病毒逃逸的风险。这项新研究中揭示的H014表位的分子特征有利于发现B谱系冠状病毒中的广泛交叉中和表位,并为基于结构的合理疫苗设计提供了令人关注的靶标。这些作者的研究结果也凸显了基于抗体的治疗性干预措施治疗COVID-19的前景。(生物谷 Bioon.com)
参考资料:
Zhe Lv et al. Structural basis for neutralization of SARS-CoV-2 and SARS-CoV by a potent therapeutic antibody. Science, 2020, doi:10.1126/science.abc5881.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


