中国药科大学杨勇/林昂团队发布首个带状疱疹mRNA疫苗与上市疫苗Shingrix的系统免疫学比对研究
来源:生物世界 2023-08-21 10:30
这项研究显示,在成年小鼠和老龄小鼠中,低、中剂量的VZV mRNA疫苗既能够明显激活病毒特异性T细胞应答,且显著优于Shingrix。此外,IL-21分泌型滤泡辅助T细胞应答也得到明显活化 (图1和2
近日,中国药科大学杨勇/林昂团队基于自主mRNA技术开发出一款新型带状疱疹mRNA疫苗(命名: ZOSAL),并在小鼠及恒河猴模型中完成了与Shingrix的头对头系统药效学比对及免疫机制学研究,研究成果在预印本bioRxiv上线,论文题为:Herpes zoster mRNA vaccine induces superior vaccine immunity over licensed vaccine in mice and rhesus macaques。

这项研究显示,在成年小鼠和老龄小鼠中,低、中剂量的VZV mRNA疫苗既能够明显激活病毒特异性T细胞应答,且显著优于Shingrix。此外,IL-21分泌型滤泡辅助T细胞应答也得到明显活化 (图1和2)。
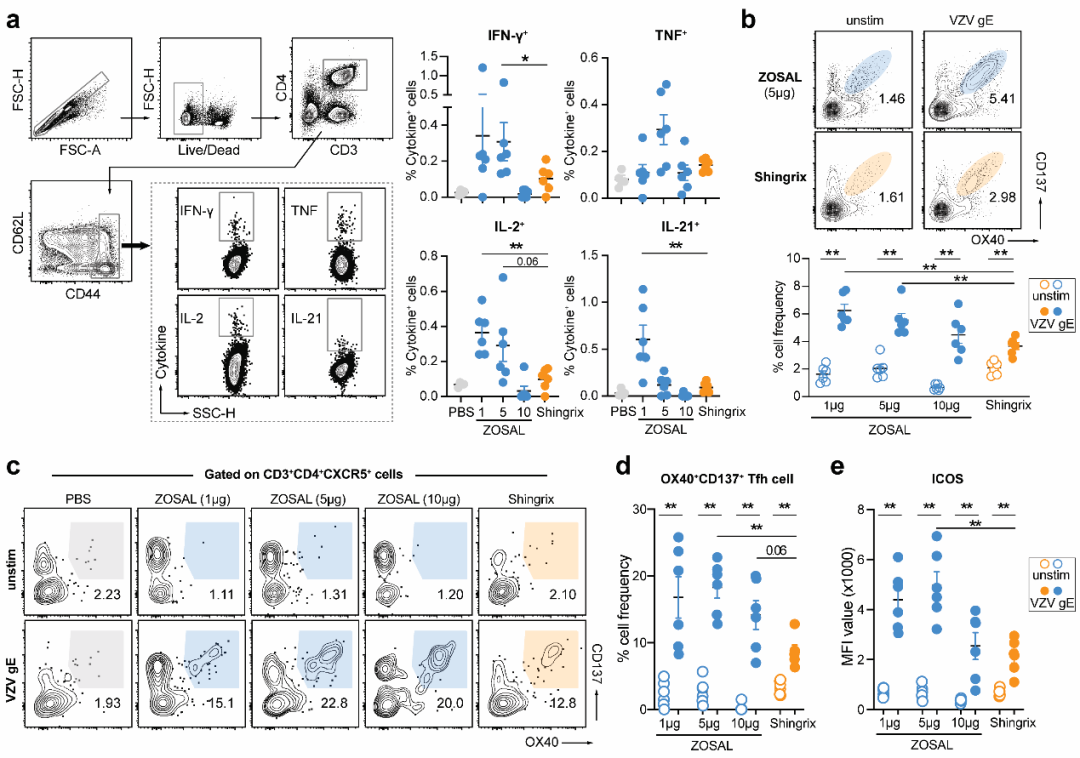 图1. 成年C57BL/6小鼠中,ZOSAL诱导出显著高于Shingrix的病毒特异性Th1型细胞应答
图1. 成年C57BL/6小鼠中,ZOSAL诱导出显著高于Shingrix的病毒特异性Th1型细胞应答
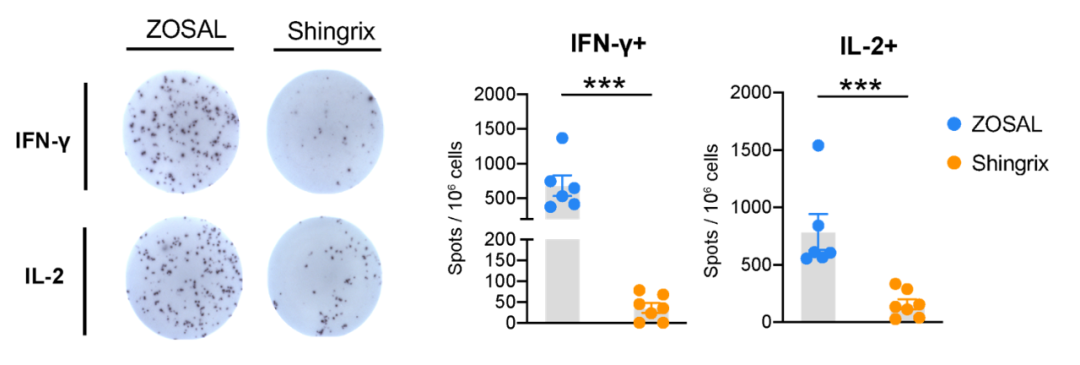 图2. 老龄C57BL/6小鼠中,ZOSAL诱导出显著高于Shingrix的病毒特异性Th1型细胞应答
图2. 老龄C57BL/6小鼠中,ZOSAL诱导出显著高于Shingrix的病毒特异性Th1型细胞应答
接下来,团队进一步使用非人灵长类动物模型开展全方位系统免疫学研究。结果显示,ZOSAL接种后的恒河猴体内产生了显著高于Shingrix组的Th1型T细胞应答。值得注意的是,单针mRNA疫苗免疫2周后既能够诱导明显的病毒特异性T细胞活化(图3)。
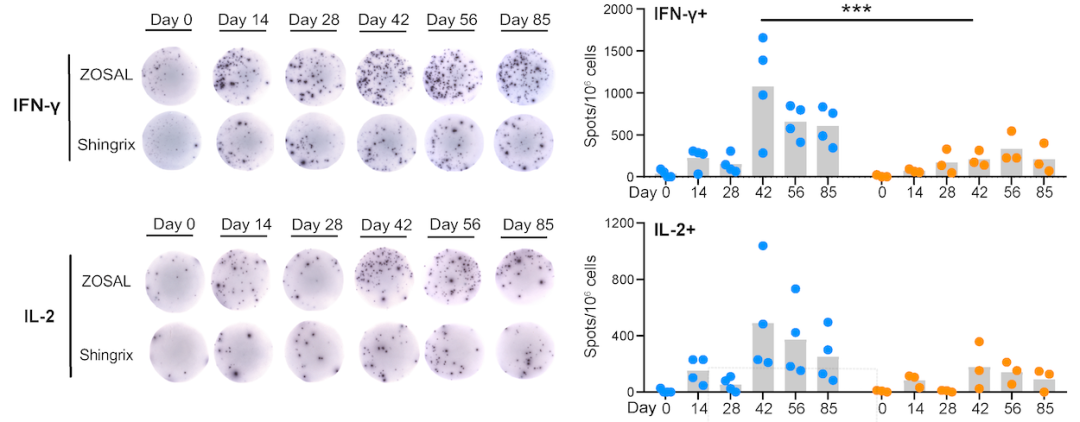
图3. 在恒河猴中,ZOSAL诱导出显著高于Shingrix的病
在此基础上,团队进一步围绕疫苗应答的发生机制展开研究。通过对二次免疫接种后24小时的恒河猴外周血淋巴细胞进行RNA测序分析,发现两款疫苗均能够显著激活以髓系细胞活化、I型干扰素通路活化、抗原加工提呈增强为主要特征的天然免疫应答指征。而意外的是,Shingrix接种在诱导T细胞活化相关基因上调的同时,也伴随诱导T细胞功能负调基因的上调。相比之下,mRNA疫苗接种后未产生该负调效应。
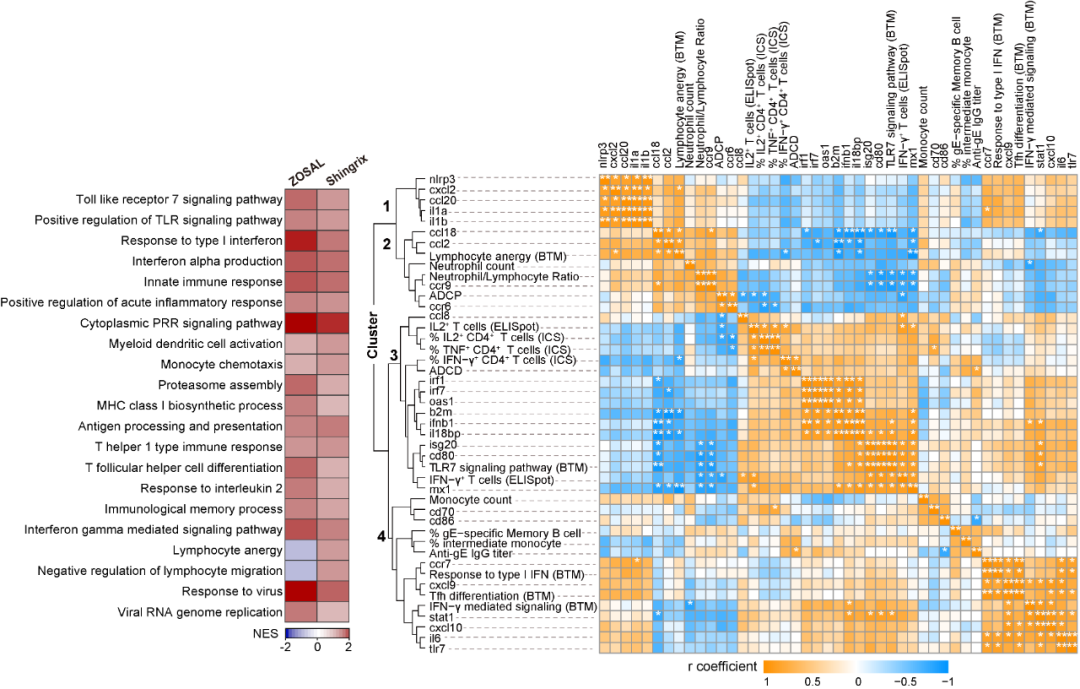 图4. 2种疱疹疫苗接种后早期天然免疫基因图谱变化和多参数相关性分析
图4. 2种疱疹疫苗接种后早期天然免疫基因图谱变化和多参数相关性分析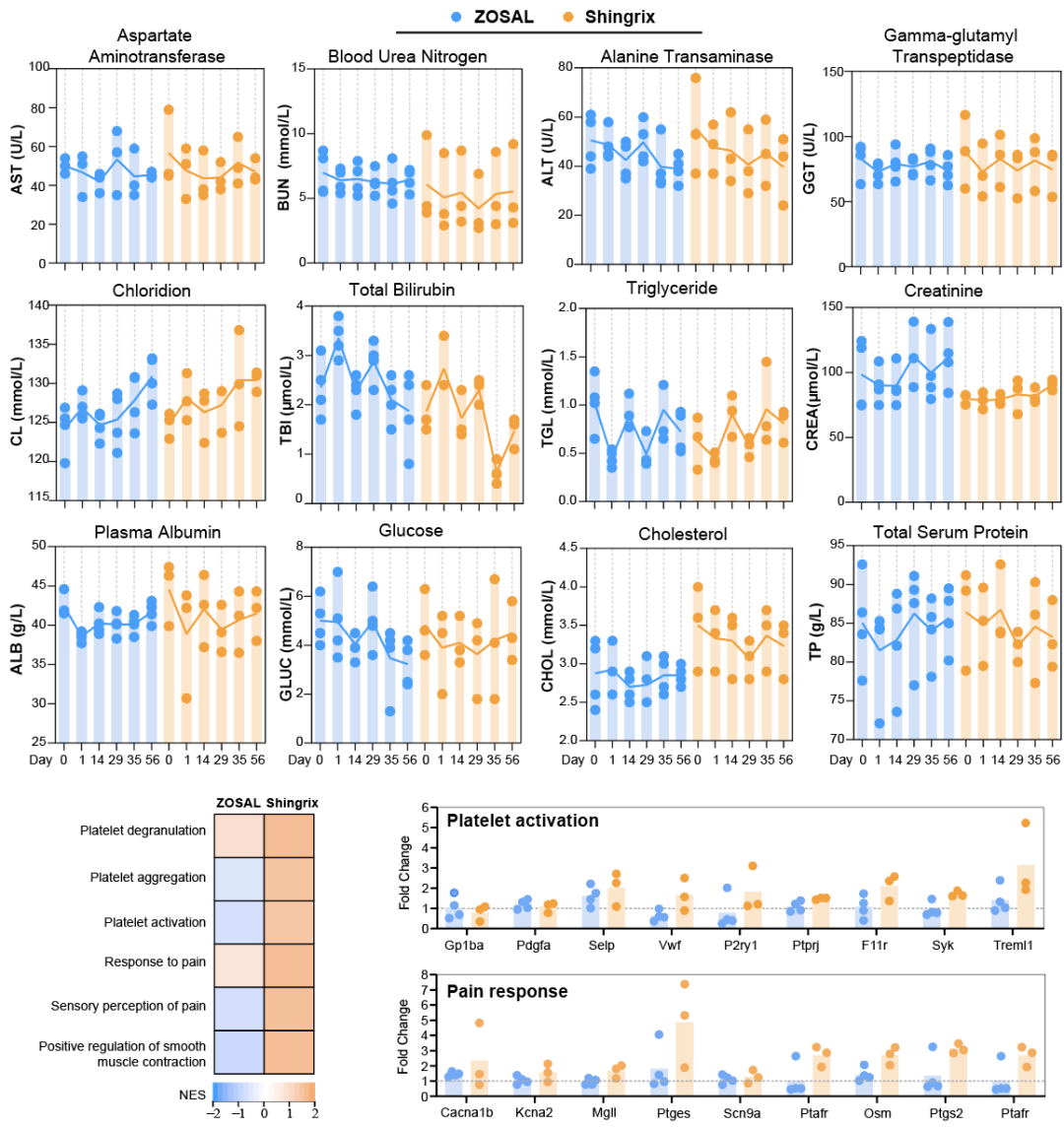
图5. ZOSAL与Shingrix在恒河猴体内的初步安全性分析
该研究的第一通讯作者中国药科大学林昂研究员表示,带状疱疹病毒的特殊性在于其初次感染后的终身潜伏,且T细胞介导了绝对的免疫保护,抗体完全不发挥作用,这恰恰对应了mRNA疫苗的优势。后疫情时代,mRNA技术如何得到科学合理的应用,在哪一类疾病的药物开发中发挥优势,是需要思考的问题。
该研究由中国药科大学、山东大学、大连医科大学、瑞典卡洛琳斯卡医学院等多家院校合作完成,并得到炉石生物在脂质分子开发等方面的技术支持。研究获得中国药科大学兴药青创启动基金、国家自然科学基金、江苏省自然科学基金、国家自然科学基金(中国-瑞典)国际合作项目等资助。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


