Cell:戴琼海/郭增才/吴嘉敏开发介观活体显微仪器RUSH3D,可全景观测哺乳动物大规模细胞间交互行为
来源:生物探索 2024-09-16 13:49
核磁共振成像与超分辨率荧光显微成像先后在大视场低分辨率宏观尺度活体观测与小视场高分辨率微观尺度离体观测上取得重大突破
核磁共振成像与超分辨率荧光显微成像先后在大视场低分辨率宏观尺度活体观测与小视场高分辨率微观尺度离体观测上取得重大突破【1】,并获得诺奖。然而,在连接微观与宏观之间的介观尺度上,由于光学像差、光毒性、组织散射、背景荧光干扰等物理限制,存在巨大的技术空白,使得当前研究难以在活体环境下同时观测复杂生命现象在器官、组织和细胞不同尺度上的时空异质性,极大地限制了脑科学、免疫学、病理学、药学等学科发展。
清华大学戴琼海院士团队早在2013年国家自然科学基金委重大科研仪器研制项目的支持下在国际上率先开展了介观活体显微成像研究,于2018年研制成功了国际首台亿像素介观荧光显微仪器RUSH【2】,被誉为介观显微成像的先驱。然而这一系统复杂昂贵,并且仍然受到光毒性,三维成像速度慢等局限,仅能限于少数科学家使用。在过去6年间,团队持续攻关这一国际前沿难题,先后提出了扫描光场成像原理【3】,数字自适应光学架构【4】,虚拟扫描算法【5】,共聚焦扫描光场【6】,自监督去噪【7】等关键理论与技术,为新一代介观活体显微仪器奠定了基础。
2024年9月13日,清华大学戴琼海,郭增才,吴嘉敏作为共同通讯在Cell上发表了文章Long-term mesoscale imaging of 3D intercellular dynamics across a mammalian organ,宣布了新一代介观活体显微仪器RUSH3D系统的问世,在兼具厘米级三维视场与亚细胞分辨率的同时,能够以20Hz的高速三维成像速度实现长达数十小时的连续低光毒性观测。相比当前市场上最先进的商业化荧光显微镜,其在同样分辨率下的成像视场面积提升近百倍,三维成像速度提升数十倍,光毒性降低上百倍(有效观测时长提升百倍)区别与传统光学显微镜聚焦于单个细胞内的物质交互过程,RUSH3D使得研究人员可以首次以全景方式动态观测哺乳动物器官尺度细胞精度的组织异质性,在活体组织中原位研究大规模多样化细胞在完整生理与病理过程中的动态交互行为。


RUSH3D成像效果(Credit: Cell)
RUSH3D系统集成了团队前期一系列成像与智能技术理论和关键技术成果,基于扫描光场成像原理,能够实现轴向400微米范围的高速三维成像的同时并具备低光毒性。针对光学像差会严重影响系统成像的分辨率, RUSH3D通过获得全视场超精细的四维空间角度数据,构建了基于波动光学的数字自适应光学架构(wDAO),无需在光学系统中增加额外的波前传感器或者空间调制器,在后端即可完成大视场多区域自适应光学像差矫正,从而提升大视场复杂环境三维成像的空间分辨率以及信噪比。这一设计使得仅需常规尺寸物镜,就能有效克服空间非一致的系统像差和样本像差难题,实现了全视场内均一高空间分辨率的十亿像素成像,显著降低介观成像系统尺寸与成本,使得高分辨活体介观显微成像系统变得更加广泛可及。除此之外,活体荧光成像中背景荧光严重影响了成像的信背比,RUSH3D采用多尺度去背景算法实现背景信号和在焦信号的分离,精准的滤除散焦背景,从而提升成像信背比,恢复淹没在荧光背景中的荧光信号。进一步与共聚焦扫描光场融合,将能在具备高通量介观观测能力的同时,实现共聚焦的成像保真度。
大规模在体三维神经记录
RUSH3D通过其跨时空的多尺度成像能力,极大拓宽了科学家对大脑的认知。大脑皮层的神经元网络被认为是高等动物神经系统中十分重要而又复杂的信息处理中心,是产生生物智能乃至意识的关键神经网络区域。然而,由于观测技术限制,目前大部分研究只能同时记录实验动物中一个或几个皮层区域的神经元活动,难以进一步研究皮层神经元网络的联合动态变化。
通过RUSH3D大视场、三维高分辨率、高帧率的成像优势,交叉团队开创性实现了对头固定下清醒小鼠背侧皮层17个脑区中十万量级大规模神经元的长时间高速三维记录,并且能够对同一群神经元进行跨天连续的追踪。运用该系统,证实了响应感觉刺激,调控运动的神经元并非只存在于单一感觉皮层、运动皮层,而是广泛存在于皮层各个区域,但各个区域神经元对感觉信息编码、整合、区分的能力存在差异。进一步发现自发运动行为发起时,小鼠皮层神经元网络由尾侧向鼻侧传导的发放模式。
这一结果提示视觉、触觉等感觉皮层神经元的信息整合和全皮层范围信号扩散可能是引起自发运动的关键因素。在此基础上,RUSH3D有望首次实现解析全背侧皮层的介观脑功能图谱,通过捕捉大脑内的成百上千万神经元间的动态连接与功能,有望能揭示意识的生物学基础,智能的本质等人类基本问题,推动对神经退行性疾病的研究,并有望推动脑启发的人工智能发展。

全脑皮层神经成像(Credit: Cell)
数十小时连续观测小鼠淋巴结范围免疫反应
RUSH3D系统为研究大规模细胞交互提供了前所未有的工具。例如,生发中心(Germinal center, GC)是被抗原激活后的B细胞在趋化作用引导下聚集形成的组织结构,对于自身免疫性疾病、疫苗、病毒感染等过程都至关重要。由于受到视场和拍摄时长的限制,免疫细胞如何参与多个GC生成以及如何在多个GC间进行迁移的过程从来没有被连续记录过,从而限制了该领域的发展。团队利用RUSH3D对小鼠腹股沟附近淋巴结在免疫反应85个小时左右进行了长达十数小时的高速三维成像,完整记录了B细胞参与多个GC生成的过程。与此同时,观测到在免疫反应145个小时GC已经完全形成之后,一些T细胞在多个GC之间完整迁移的过程,预示了T细胞可能参与了GC之间的信息交流和传递。这些对信使T细胞在不同生发中心之间交流信息的观测有望带来我们对免疫过程的全新认识。
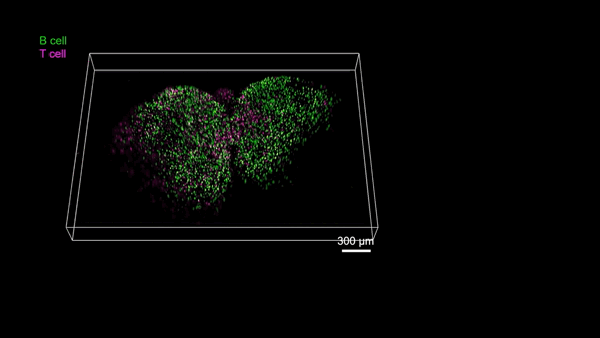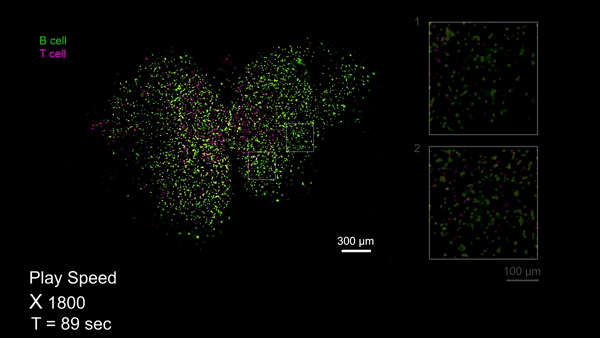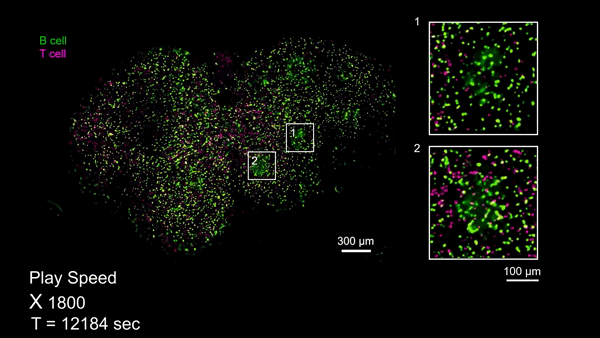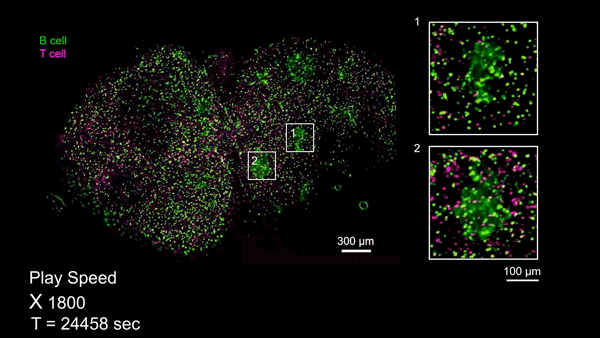
B淋巴细胞参与小鼠淋巴结多个生发中心形成的完整过程(Credit: Cell)

T淋巴细胞在多个生发中心之间迁移的完整过程(Credit: Cell)
跨尺度精准解析,医学研究的革命性工具
跨时空的多尺度成像能力使得RUSH3D极大提升了实验效率。例如,药物筛选实验能够在单次实验中显著提高效率,免去多次试验需求。同时,由于RUSH3D可以提供足够数据进行统计分析,跨个体差异可以在一次实验中得到有效缓解。此外,诸如肿瘤转移等稀有事件,在RUSH3D的观察中将不再是偶发事件,而是常规可见现象,成百上千倍地提升了活体生物发现的效率。凭借其低光毒性三维观测的优势,该系统还能够同时观察到细胞间的长距离通信,并通过长时间追踪数百万个细胞,揭示集体细胞行为的物理规律和功能涌现的机制,例如能够捕捉从肿瘤发生开始到免疫应答、肿瘤生长的全过程,揭示肿瘤产生的完整免疫活化反应。
作为RUSH3D在医学领域的初探,研究人员首次观测到了急性脑损伤(脑震荡等)后整个大脑皮层范围内的中性粒细胞迁移活动。当小鼠的脑部受到撞击以后,大量的中心粒细胞从血管周边非血管区域流出进入脑实质,也有极罕见的细胞从脑实质回流到血管里,这意味着有些细胞可能通过类淋巴系统进入脑实质,并且会流回血管中将信息传递到生物体的其他地方。通过国际首次捕捉对脑损伤修复过程单细胞水平的免疫反应,有助于开发特定疗法避免急性脑损伤后组织水肿带来的脑功能缺失难题,并为更广泛的脑疾病等医学问题提供新视角。
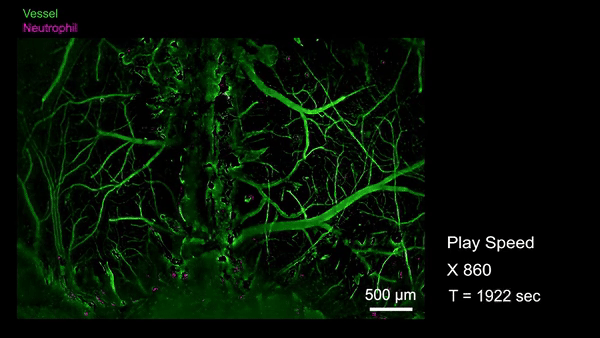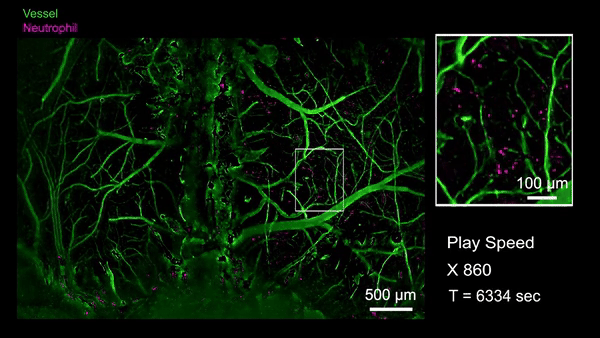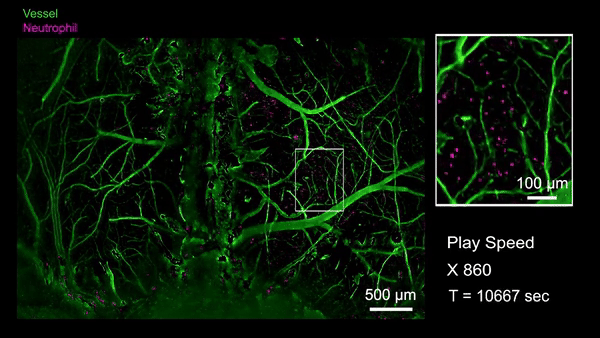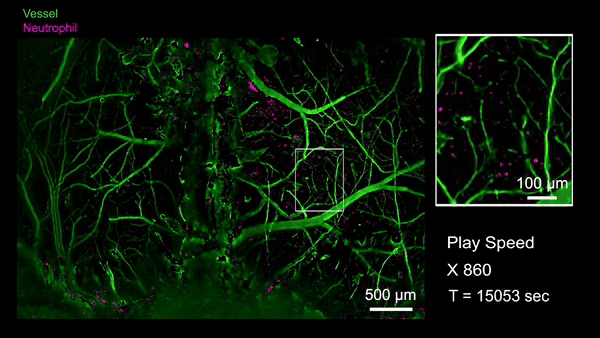
急性脑损伤后全皮层范围单细胞水平免疫反应(Credit: Cell)
参考文献
1.Raichle, Marcus E., and Mark A. Mintun. "Brain work and brain imaging." Annu. Rev. Neurosci. 29.1 (2006): 449-476.
2.Fan, Jingtao, et al. Video-rate imaging of biological dynamics at centimetre scale and micrometre resolution. Nat. Photonics 13, 809–816 (2019).
3.Wu, Jiamin, et al. Iterative tomography with digital adaptive optics permits hour-long intravital observation of 3D subcellular dynamics at millisecond scale. Cell, 184, 3318-3332 (2021).
4.Wu, Jiamin, et al. An integrated imaging sensor for aberration-corrected 3D photography, Nature, 612, 62-71, 2022.
5.Lu, Zhi, et al. Virtual-scanning light-field microscopy for robust snapshot high-resolution volumetric imaging. Nat Methods 20, 735–746 (2023).
6.Lu, Zhi, et al. Long-term intravital subcellular imaging with confocal scanning light-field microscopy. Nat Biotechnol (2024).
7.Li, Xinyang, et al. Real-time denoising enables high-sensitivity fluorescence time-lapse imaging beyond the shot-noise limit. Nat Biotechnol 41, 282–292 (2023).
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


