Sana公司证实年轻健康的人类神经胶质祖细胞可竞争性替代患病和衰老脑细胞
来源:生物世界 2023-07-21 14:53
这项研究结果显示,同种异体HIP CD19 CAR-T细胞在免疫功能正常的人源化小鼠肿瘤模型中是安全的,且能够实现持久、有效的肿瘤清除效果。基于低免疫T细胞的“通用型”CAR-T细胞疗法能够达到目前只
神经退行性疾病,是一类因进行性神经细胞死亡而导致功能障碍的疾病,包括阿尔茨海默病(AD)、帕金森病(PD)、亨廷顿舞蹈症(HD),以及渐冻症(ALS)等等。目前,神经退行性疾病的病因通常并不明确,因此无法治愈,严重威胁着人类健康的同时也造成了巨大的家庭、经济和社会负担。
这些神经退行性疾病,以及脑中风,都会导致大量神经元丢失。因此,如果能在患者体内再生这些神经元,就能从根本上治愈这些重大疾病。
2023年7月17日,干细胞治疗公司 Sana Biotechnology 联合哥本哈根大学、罗切斯特大学的研究人员,在 Nature Biotechnology 期刊发表了题为:Young glial progenitor cells competitively replace aged and diseased human glia in the adult chimeric mouse brain 的研究论文。
该研究描述了人类神经胶质祖细胞(hGPC)在成年大脑中相互竞争的能力,以及年轻和健康细胞在衰老和患病细胞上的竞争优势。
这些研究结果表明,在成年大脑中,病变的人类神经胶质细胞可以被更年轻、更健康的hGPC广泛取代, 由此提出了在神经退行性疾病患者中替换神经胶质细胞的治疗策略。

在此之前,许多研究已经注意到,与神经元丢失相关的各种疾病在很大程度上似乎是由功能失调的神经胶质细胞引起的。换而言之,神经胶质细胞功能障碍会导致广泛的神经系统疾病。这使得这些疾病成为基于干细胞和祖细胞的治疗的有吸引力的目标。
值得一提的是,人类神经胶质祖细胞(hGPC)是一类重要的前体细胞,具有在宿主中分散和定植的能力,同时产生新的星形胶质细胞和少突胶质细胞,这是神经胶质细胞的两种主要类型。因此,如果能用健康的hGPC替代病变的神经胶质细胞,将可能会带来切实的治疗效果。
早在2013年,Steve Goldman 教授团队首次报道了从胚胎干细胞中产生大脑神经胶质支持细胞的策略。在后来的研究中,研究团队将这些细胞移植到幼鼠的大脑中,培育出了人类神经胶质嵌合小鼠。这是一项杰出的技术成就,使得科学家们能够研究活体大脑中的人类神经胶质细胞。有趣的是,在移植后,人类神经胶质祖细胞迅速战胜了原生细胞,形成了具有小鼠神经元和人类神经胶质的嵌合大脑。

Steve Goldman
Steve Goldman 是 Sana Biotechnology 公司的高级副总裁、CNS疗法负责人,也是哥本哈根大学和罗彻斯特大学医学中心的教授。
在后来的实验中,研究团队移植了带有亨廷顿舞蹈症突变(mHTT)的人类神经胶质细胞,这种突变损害了胶质祖细胞的功能,导致星形胶质细胞和少突胶质细胞的产生不良。Steve Goldman 团队还发现,将健康的人类神经胶质祖细胞移植到亨廷顿舞蹈症的小鼠模型中,可以延缓疾病的进展。
然而,这些研究仅限于将人类细胞移植到小鼠大脑中,对于同种异体移植的hGPC是否可以取代其他人类细胞,即将人类细胞移植到另一个人脑中是否会产生类似的益处,目前还不清楚。
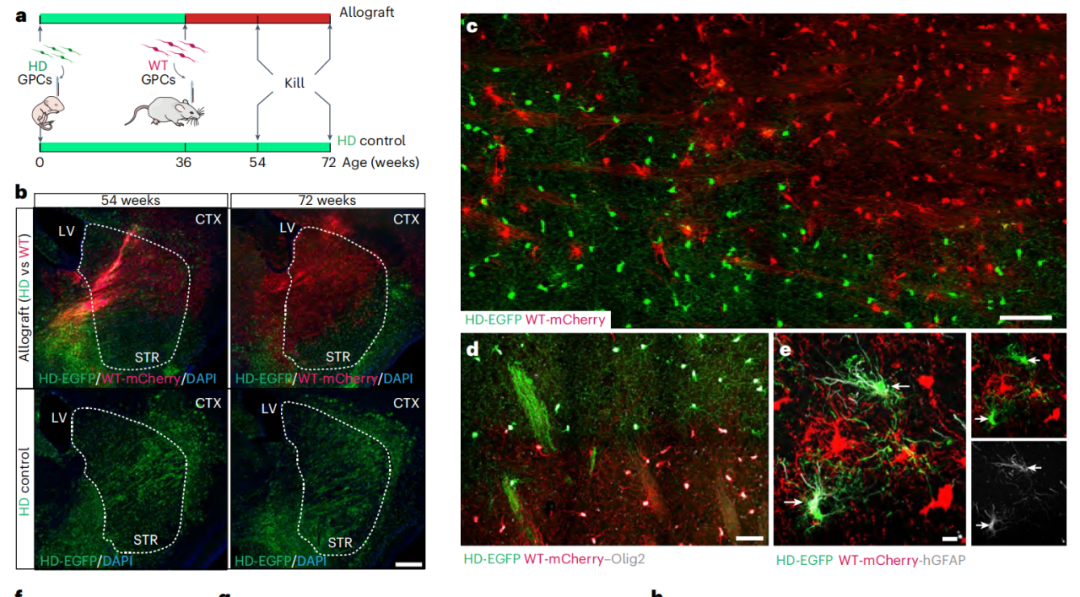
将野生型胶质细胞移植到亨廷顿症嵌合体小鼠的大脑纹状体中,产生了亨廷顿症胶质细胞的渐进式替代
如今,这项发表于 Nature Biotechnology 的最新研究证实,这种方式是可行的,并强调了细胞替代疗法的潜在价值,表明健康的人类神经胶质细胞将胜过并取代患病的人类细胞。
为了证明这一点,研究团队首先将HTT基因突变(mHTT)的人类神经胶质祖细胞(hGPC)植入新生小鼠的大脑。在植入之后,这些神经胶质细胞迅速渗透到这些小鼠大脑的纹状体,首先在纹状体白质束内迁移和扩张,然后逐渐取代小鼠纹状体神经节中的对应细胞,由此生成携带mHTT的嵌合纹状体。
待这些小鼠成年后,研究团队又将健康的野生型人神经胶质祖细胞(hGPC)移植到其大脑内。植入后,这些野生型hGPC细胞遍布先前的人源嵌合纹状体,随着它们从植入部位扩张和迁移,逐渐取代并清除携带mHTT的病变细胞。这个过程缓慢但持续,随着时间的推移,亨廷顿症病变纹状体会再生出大量的健康胶质细胞。

健康的野生型胶质细胞战胜亨廷顿症病变胶质细胞,并将其取代和清除
Steve Goldman 教授表示,实际上,你可以看到迁移的迹象和一个边界,在那里,表达mHTT的胶质细胞正在死亡,并被健康胶质细胞所取代。最终,在目标区域(嵌合纹状体),健康的胶质细胞基本把病变细胞剔除出去,完全将其取代。
研究团队还发现,年轻、健康的人类神经胶质祖细胞(hGPC)在竞争中胜过衰老、健康的人类神经胶质细胞,这表明年轻是竞争成功的关键决定因素。
这些结果表明,年轻的hGPC对人类野生型神经胶质嵌合纹状体的再生是由年轻的同类细胞取代年老的细胞引起的,部分原因是年轻的、有丝分裂更活跃的细胞群体更容易扩张。
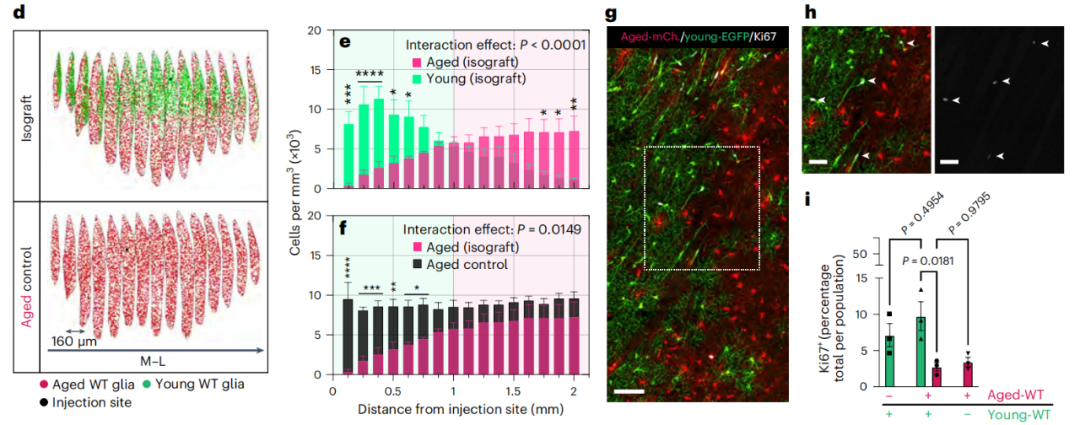
细胞年龄的差异足以驱动人源化纹状体的竞争性再生
此外,该还发现,衰老的神经胶质细胞被引入的年轻的神经胶质细胞主动消灭,至少部分是通过细胞凋亡,这是由于后者的相对适应性更强,允许它们在嵌合纹状体中重新增殖。
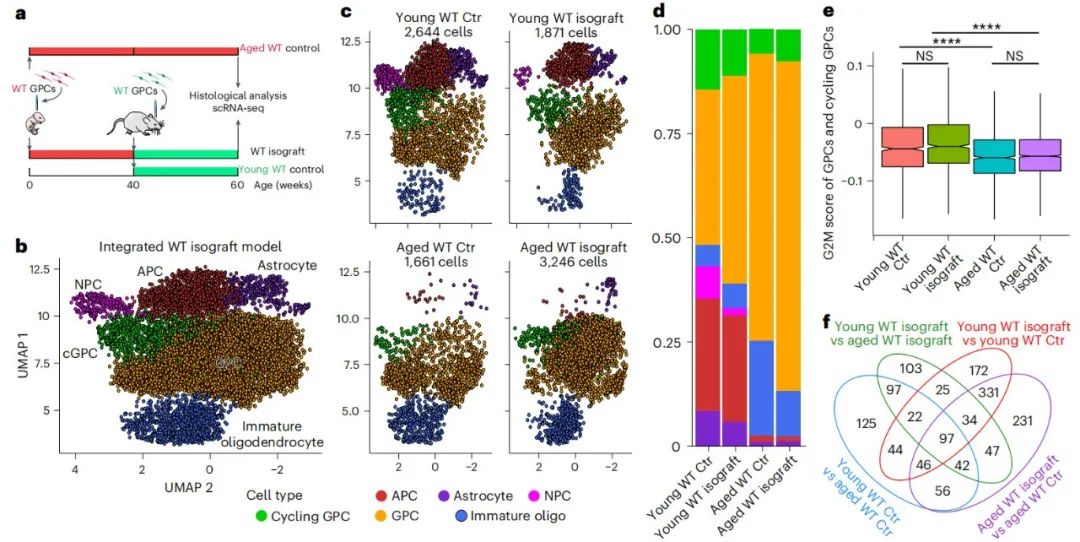
野生型胶质细胞在面对衰老的同类细胞时获得显性转录谱
这项具有很强的治疗意义,因为这些结果表明,在成年人的大脑中,无论是患病的还是衰老的细胞,都可能在引入更年轻、更健康的细胞后被取代。这表明,在各种病因和表型的患病大脑中,功能失调的神经胶质细胞可以被有效地消除并取代,hGPC输送和神经胶质细胞替代可能为众多神经退行性疾病的细胞治疗提供了一种可行且广泛适用的策略。

Sana Biotechnology 是由前 Juno Therapeutics 公司的几位联合创始人,和在细胞生物学、基因疗法、合成生物学等领域的专家共同领导的明星细胞疗法公司。在体内疗法方面,Sana 期望使用其细胞编辑平台,治疗由于基因缺陷引起的遗传病。其关键在于将细胞进行各种精准的基因编辑,并将这些细胞以任意载量送入人体内的任意一个部位。而在体外疗法方面,Sana 希望能将干细胞分化成临床上所需要的各种细胞类型,用来替换体内的受损细胞,从而改变许多疾病的治疗。
Sana 的研发管线分为2个大方向,分别是体内细胞工程、体外细胞工程。治疗方向包括肿瘤、罕见遗传病、糖尿病,以及神经退行性疾病和心力衰竭等。目前 Sana 有超过10条研发管线,其中CD19靶向的同种异体CAR-T细胞疗法SC291处于1期临床试验阶段。
2023年4月,Sana 在 Nature Communications 期刊发表了SC291的临床前研究数据【2】。该研究通过CRISPR-Cas9基因编辑敲除了T细胞的TRAC、B2M和CIITA基因,从而构建出了人类低免疫(HIP)T细胞。然后,使用慢病毒载体让这些HIP T细胞过表达CD47和CD19 CAR,构建出了同种异体HIP CD19 CAR-T细胞。

版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


