PNAS丨厦门大学曹彬团队合作发现决定人类及小鼠胎盘滋养层细胞合体化的全新转录因子
来源:网络 2024-07-16 10:37
该研究首次揭示转录因子TFEB在人类及小鼠胎盘滋养层细胞合体化过程中的保守性调控作用,阐明了mTORC1-TFEB-ERVFRD-1作用轴介导滋养层细胞融合的全新分子调控路径。
胎盘作为母胎间物质及信息交流的纽带对于妊娠建立及维持至关重要,其正常发育与否直接决定妊娠结局甚至子代远期健康。母胎间复杂对话主要由胎盘滋养层细胞,尤其是胎盘表面直接接触母血的合体滋养层细胞(Syncytiotrophoblast,STB)来介导。STB为迄今已知人体内最大的多核细胞,由具有滋养层干细胞特性的细胞滋养层细胞(Cytotrophoblast,CTB)通过细胞融合形成,这一个过程被称为滋养层细胞合体化。合体化受到复杂的细胞分子机制调节,包括细胞膜重塑,细胞骨架重排,转录激活及表观调控等。研究团队前期研究发现,滋养层细胞能够精确感知营养缺乏压力,抑制mTOR信号,通过促进合体化和巨胞饮的方式提高营养获取效率从而补偿母体营养供应不足,最大限度保障胎儿发育的需求【1】。
上述工作首次提出胎盘通过促进合体化主动应对孕期营养匮乏压力的独特策略,但是营养缺乏信号促进滋养层细胞合体化的具体调控机制仍然未知。近期,厦门大学曹彬/胡晓倩课题组和中国科学院动物研究所王雁玲课题组联合在PNAS在线发表题为TFEB safeguards trophoblast syncytialization in humans and mice的研究论文,利用多种人类胎盘滋养细胞模型、基因敲除小鼠模型以及人类胎儿生长受限(FGR)临床样本开展综合研究,首次揭示了mTORC1-TFEB-ERVFRD-1作用轴调控滋养层合体化的全新机制,对滋养层细胞从营养感知到合体化之间的机制闭环进行了完整解析。

首先,研究人员发现在mTORC1下游众多靶基因中TFEB具有特殊的表达模式,其在单核的CTB细胞中高表达,并随着合体化进程逐步降低。利用人原代滋养细胞、人滋养层细胞系BeWo细胞、人类滋养层干细胞(hTSC)及胎盘类器官等滋养细胞合体化模型,结合功能缺失及获得实验证明TFEB 在细胞滋养层细胞中的高表达对于STB 分化不可或缺。TFEB是介导自噬-溶酶体通路相关基因转录的关键转录因子【2】,但该研究发现其促进滋养层细胞合体化的作用并不依赖经典的自噬溶酶体通路调控活性。基于此,研究人员进一步通过TFEB ChIP-seq分析寻找介导滋养层细胞合体化的关键TFEB靶基因。在众多靶基因中,研究人员将目光聚焦到一个来源于内源性逆转录病毒序列的滋养层细胞融合基因ERVFRD-1。通过基因敲除,荧光素酶报告系统及序列突变等实验,证实TFEB可以通过直接结合ERVFRD-1启动子区域的两个CLEAR 基序驱动转录激活,这一机制完全独立于被广泛研究的PKA-GCM1合体化分子调控路径【3】。更为重要的是,在TFEB功能缺失的滋养层细胞里回补ERVFRD-1可以完全挽救合体化缺陷表型。
除此之外,研究团队证明TFEB直接介导了由于营养缺乏而增强的滋养层细胞融合。FGR是产科临床常见的妊娠疾病,由于直接或间接因素导致的营养供给不足使胎儿无法达到其应用生长潜力。研究发现TFEB表达量在FGR胎盘中显著升高,并与FGR胎盘中代偿升高的合体化程度及ERVFRD-1表达水平密切相关。上述结果提示TFEB可以作为胎盘响应营养匮乏信号的重要效应分子,通过促进滋养层合体化提升胎盘的营养转运效率藉此保障胎儿生长发育。
研究团队利用Tfeb全身敲除小鼠模型,发现Tfeb缺失导致胚胎致死和胎盘发育障碍,表现为胎盘迷路层(母胎血液交换活跃区)变薄,胎盘血管网络异常。研究人员进一步在Tfeb滋养细胞特异性敲除小鼠中重现了全身敲除鼠的胎盘表型,确认了 Tfeb敲除导致的胎盘迷路层血管发育障碍是由滋养细胞分化异常所致。研究人员结合单细胞转录组分析及细致胎盘表型分析发现,Tfeb缺失引起母体血相接触的I型合胞体细胞(SynT-I)完全性缺失,首次利用胎盘条件性敲除小鼠模型,寻找到影响SynT-I谱系分化的特异性关键转录因子TFEB。
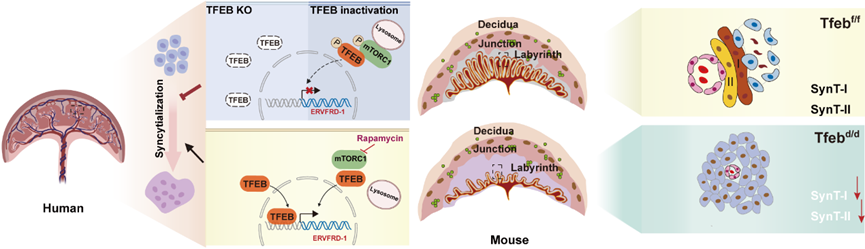
TFEB 调控人类和小鼠胎盘滋养细胞合体化的机制模式图(Credit: PNAS)
综上,该研究首次揭示转录因子TFEB在人类及小鼠胎盘滋养层细胞合体化过程中的保守性调控作用,阐明了mTORC1-TFEB-ERVFRD-1作用轴介导滋养层细胞融合的全新分子调控路径,填补了营养缺乏与滋养层细胞合体化间的机制空白。该研究为研究滋养层细胞合体化机制及揭示相关妊娠疾病的发病机理提供了重要的理论支撑。
参考文献:
1. X. Shao et al., Placental trophoblast syncytialization potentiates macropinocytosis via mTOR signaling to adapt to reduced amino acid supply. Proc Natl Acad Sci U S A 118 (2021).
2. C. Settembre et al., TFEB links autophagy to lysosomal biogenesis. Science 332, 1429-1433 (2011).
3. I. Knerr et al., Stimulation of GCMa and syncytin via cAMP mediated PKA signaling in human trophoblastic cells under normoxic and hypoxic conditions. FEBS Lett 579, 3991-3998 (2005).
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


