Immunity:徐强团队揭示IL-17受体信号的自激活可维持炎症持续并促进疾病进展
来源:生物世界 2023-08-08 15:33
该研究揭示了基础IL-17信号中一个过去未被报道过的“后门”机制——由IL-17A诱导SHP2高表达,随后形成IL-17R-Act1-SHP2复合物,介导IL-17R信号自激活。必须指出的是,这一后门
IL-17是一种主要由Th17细胞产生的关键促炎症细胞因子,在多种自身免疫性疾病患者中高表达,包括银屑病、银屑病关节炎、类风湿关节炎和多发性硬化症等,并与这些疾病的发生发展密切相关。
目前临床治疗主要采用抗体类疗法直接靶向IL-17或其受体IL-17R阻断其信号转导。然而,除银屑病等少数疾病外,该疗法在多种IL-17相关疾病的临床试验中因无效甚至加重疾病而宣告失败或被迫中止。这些与其发病机理相矛盾的现象原因未明,不仅极大地限制了抗IL-17疗法在相关疾病中的应用前景,也提示IL-17信号中可能存在未知的分子事件。
近日,南京大学生命科学学院徐强教授团队在 Immunity 期刊发表了题为:An autonomous activation of interleukin-17 receptor signal sustains inflammation and promotes disease progression 的研究论文。
该研究揭示了基础IL-17信号中一个过去未被报道过的“后门”机制——由IL-17A诱导SHP2高表达,随后形成IL-17R-Act1-SHP2复合物,介导IL-17R信号自激活。必须指出的是,这一后门机制系IL-17A本身主动设置,目的是加速和维持炎症的长期持续,并抵御相应的抗IL-17疗法。
该研究首次回答了长期以来IL-17炎症为什么会走向慢性化的问题,解释了抗IL-17疗法对于相关疾病的临床试验为什么屡遭失败的原因,还展示了靶向该自激活机制的应用前景。类似这样的“后门”机制也可能存在于其他炎症信号通路中,可望为慢性炎症性疾病的治疗开辟新的途径。

研究团队首先发现磷酸酶SHP2在多种自身免疫性疾病的病灶组织、相关动物模型和IL-17A刺激的细胞上高表达。令人意外的是,高表达SHP2后,无IL-17A刺激时细胞内IL-17R信号依然存在,但抗IL-17A单抗GR1501和Cosentyx对IL-17A信号的抑制作用则完全消失。另外,在小鼠胶原关节炎模型中,第二次免疫(第24天)即开始用抗IL-17A抗体治疗,可显著改善关节炎。然而,当临床评分达到3分(SHP2表达升高)以后(第31天)再开始给药,抗体的改善作用几乎消失。
研究团队接下来发现星形胶质细胞特异性诱导敲除SHP2小鼠EAE发病延迟,且疾病严重程度降低,脊髓组织中CCL2、CXCL1和CXCL2等显著减少,表明SHP2对IL-17信号的增强和维持至关重要。研究团队还发现这种现象并非星形胶质细胞所特有,可能是表达IL-17R的不同类型组织细胞的共同特征。
随后研究团队考察了SHP2是如何参与IL-17信号转导的。通过多种实验证实,SHP2可以和IL-17通路重要接头蛋白Act1相互作用,并且占据了TRAF5所结合的Act1的TRAF结构域,形成IL-17R-Act1-SHP2复合物,从而介导IL-17R信号的自激活。进一步发现,这种自激活依赖于SHP2的酶活,而SHP2发挥磷酸酶作用的底物是Act1,IL-17A刺激下Act1的酪氨酸磷酸化水平降低,SHP2 可以直接使Act1的Y548位发生去磷酸化,从而取代Act1-TRAF5复合物并激活IL-17R信号转导,促进相关疾病进展。这些结果表明,SHP2介导的Act1酪氨酸去磷酸化是IL-17R信号自激活的关键步骤,
研究团队随后证实,抗类风湿性关节炎药物艾拉莫德可以直接竞争结合Act1的TRAF结构域,分别阻断Act1与TRAF5和SHP2的相互作用,从而实现对基础IL-17信号和持续IL-17R信号转导的双重抑制。其在阻止疾病进展方面与抗IL-17抗体有着截然不同的表现,在上述抗IL-17抗体给药无效的时间段(第31天开始)给予艾拉莫德仍显著抑制小鼠胶原关节炎进展,这也提示了靶向自激活机制具有良好的应用前景,可为今后的新药研究奠定基础。
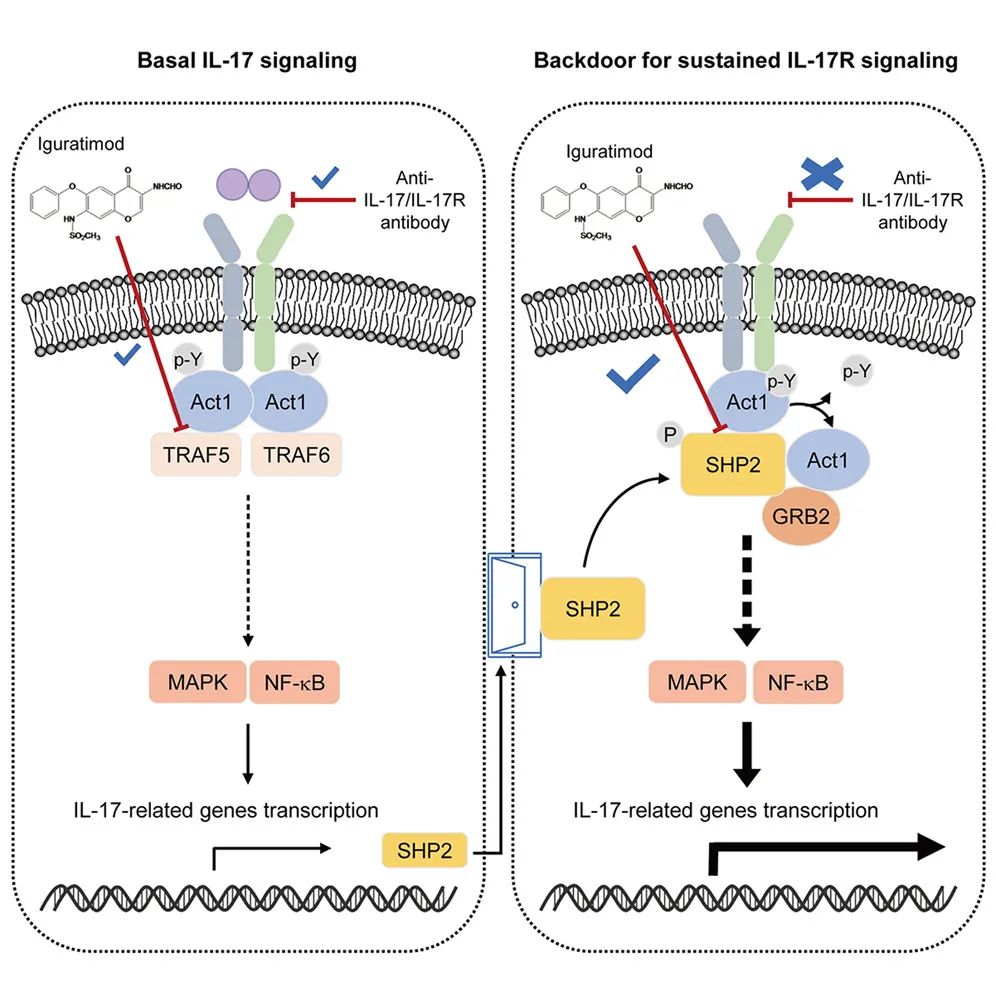
基础IL-17信号及其“后门”IL-17R信号
综上所述,该研究揭示了基础IL-17信号中一个过去未被报道过的“后门”机制——由IL-17A诱导SHP2高表达,随后形成IL-17R-Act1-SHP2复合物,介导IL-17R信号自激活。必须指出的是,这一后门机制系IL-17A本身主动设置,目的是加速和维持炎症的长期持续,并抵御相应的抗IL-17疗法。该研究首次回答了长期以来IL-17炎症为什么会走向慢性化的问题,解释了抗IL-17疗法对于相关疾病的临床试验为什么屡遭失败的原因,还展示了靶向该自激活机制的应用前景。类似这样的“后门”机制也可能存在于其他炎症信号通路中,可望为慢性炎症性疾病的治疗开辟新的途径。
南京大学生命科学学院徐强教授为该论文的主要通讯作者,南京大学生命科学学院特任副研究员罗琼为第一作者和共同通讯作者。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


