《科学》子刊:Aβ生理功能新发现!导致家族性阿尔茨海默病的瑞典型突变APP,竟能提高神经元突触密度!
来源:奇点糕 2022-11-17 16:19
这项研究的实验结果表明,虽然在长久以来Aβ和APP都被视为造成阿尔茨海默病细胞毒性的关键物质和基因[9,13],但在生理环境下,APP至少能够通过产生Aβ来促进人类神经元突触的形成。
阿尔茨海默病是导致失智症的主要病因,其主要病理特点之一是β淀粉样蛋白(Aβ)形成的Aβ斑块[1-2]。
Aβ是淀粉样前体蛋白(APP)的一类水解产物,根据其肽链长度不同有不同的生理特性。在部分家族性阿尔茨海默病中,编码APP的基因发生了突变,导致其水解得到的Aβ产物也发生了变化[3]。突变产生的Aβ产物会在大脑中沉积,并对神经元产生毒性,因此Aβ至今都被研究者认为在疾病中扮演着重要的角色。
近年来,许多阿尔茨海默病药物的都致力于消除Aβ沉积和斑块,其中就包括了著名的aducanumab。但在此之前多数靶向Aβ的药物疗效都不尽人意,有些甚至加重了病人的认知衰退[4-6]。随着越来越多关于Aβ和阿尔茨海默病因果关系的讨论,科学家们正在重新认识和考量Aβ在正常生理条件和疾病条件下的作用。
近日,由斯坦福大学Thomas C. Südhof和Marius Wernig领衔的研究团队,在著名期刊SCIENCE TRANSLATIONAL MEDICINE上发表重要研究成果[7]。
他们发现与表达正常APP基因的神经元相比,携带瑞典型突变APP(能促进β-分泌酶对APP的裂解,从而增加Aβ的产生,进而导致家族性阿尔茨海默病)的神经元突触数量增加约20%,而且敲除APP基因则会减少突触数量和突触连接。
这一研究表明,Aβ蛋白与阿尔茨海默病的关系非常复杂。此外,研究人员还认为,这一研究成果也解释了在BACE抑制剂临床试验中观察到的认知障碍现象。

论文首页截图
为了研究单基因突变对神经元的影响,Südhof团队没有使用之前研究中使用的需要克隆传代和筛选的细胞系,而是通过腺相关病毒转染后,在正常的人类胚胎干细胞和诱导多能细胞中,产生了具有瑞典型突变的APP(K595N/M596L)[8]和正常的APP两种表型,并诱导其分化成兴奋性神经元。瑞典型突变发生在APP的16号外显子上,是导致家族型阿尔茨海默病的遗传因素之一。
经过改造的神经元(APPSwe/+)除了携带APP瑞典型突变以外,其余基因序列与野生型神经元(APP+/+)一致。Südhof团队发现,APPSwe/+神经元与APP+/+神经元相比,在表达相同水平的APP同时,伴随着Aβ40和Aβ42的含量的升高(P<0.05)。除此之外,APPSwe/+神经元还表现出磷酸化Tau蛋白水平的升高,但神经元的树突结构和胞体大小并没有很大的变化。
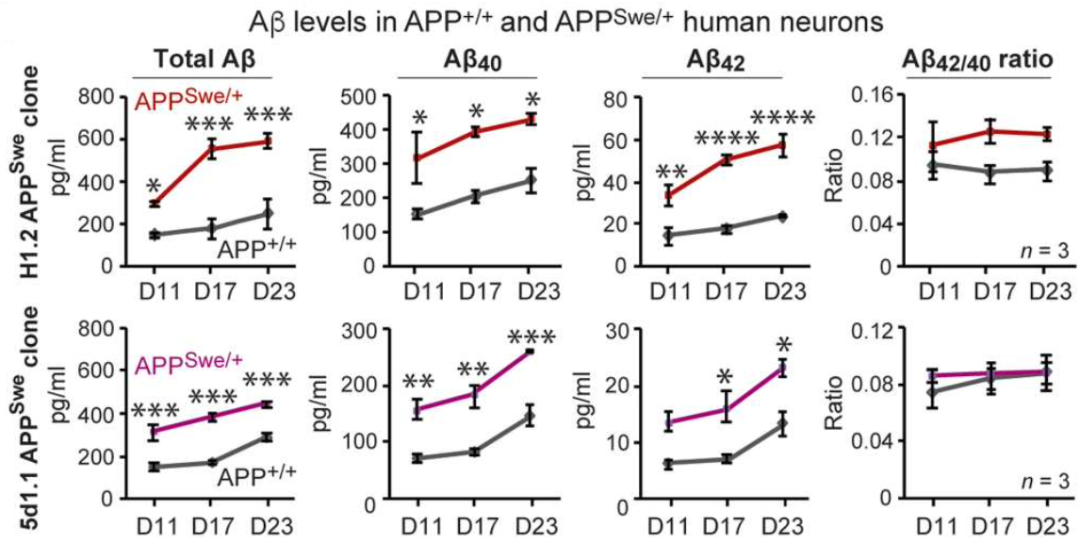
APPSwe/+神经元中Aβ40和Aβ42的含量升高
随后Südhof团队通过免疫组化和蛋白印记的实验分析发现,相比于APP+/+神经元,APPSwe/+神经元的突触密度增加了约20%,突触相关的蛋白标志物的表达也提高了20%-80%。
这一发现让研究人员大吃一惊,因为Aβ在主流学说中一直被视为阿尔茨海默病的病理性“毒蛋白”,有大量的研究表明Aβ在人体内、老鼠模型和细胞模型中都产生了神经元毒性,会促进谷氨酸受体的胞吞作用以及阻碍记忆的形成[9-12]。
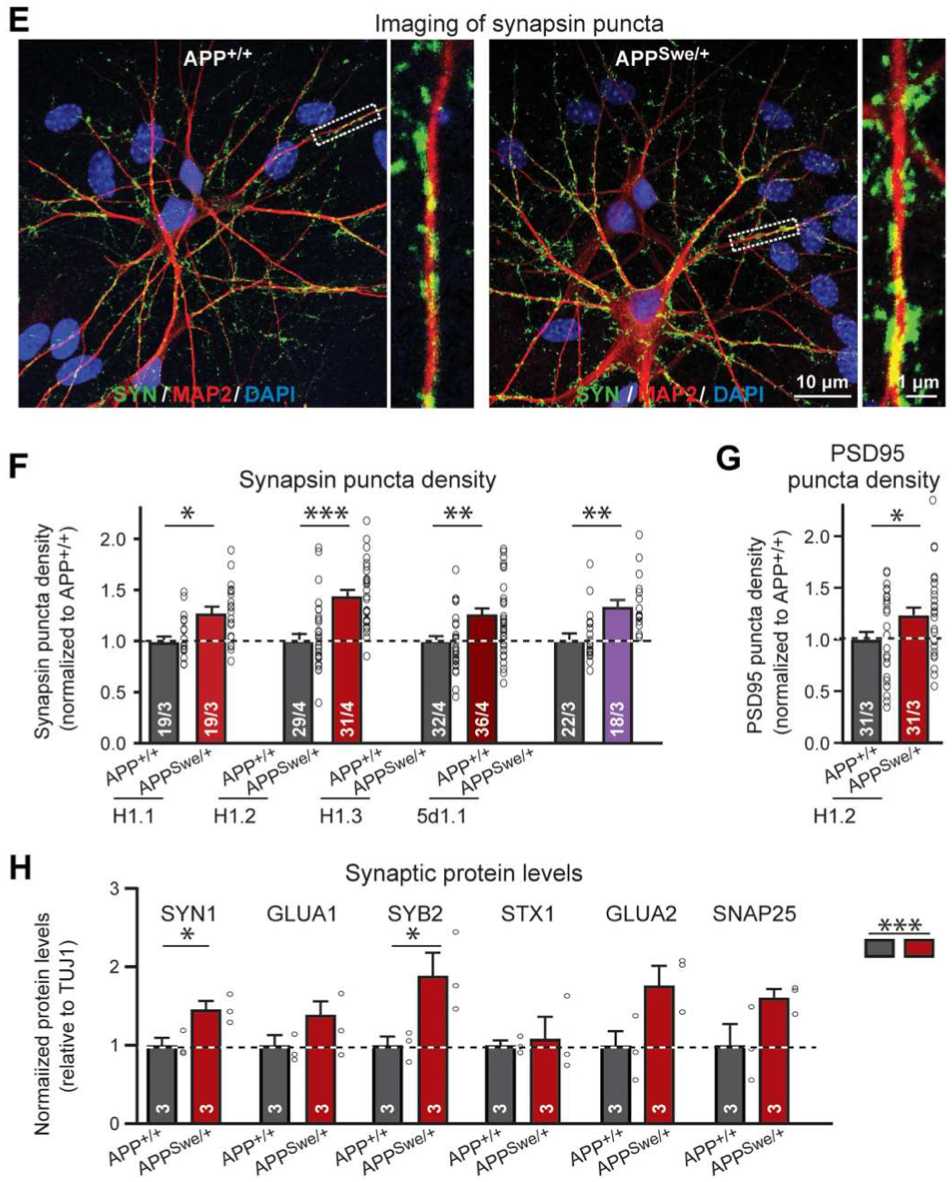
APPSwe/+神经元的突触密度和相关蛋白标志物的表达都有显著上升
因此为了进一步验证这一结果,Südhof团队继续进行了电生理实验。而电生理实验的结果表明,APPSwe/+神经元的自发微型兴奋性突触电流(mEPSC)的频率增加了约30%,mEPSC频率的变化是反应突触数量变化的指标之一。
之前的研究表明,APP的瑞典型突变会导致β分泌酶(BACE1)的剪切作用增强,进而导致Aβ产物增加。因此Südhof团队为了验证Aβ产物对突触的影响,在两种神经元的培养液中加入了BACE1抑制剂LY2886721。结果发现加入了抑制剂后,APP+/+神经元的突触数量减少了约30%,APPSwe/+神经元中的突触增加也被遏止了(P<0.01)。
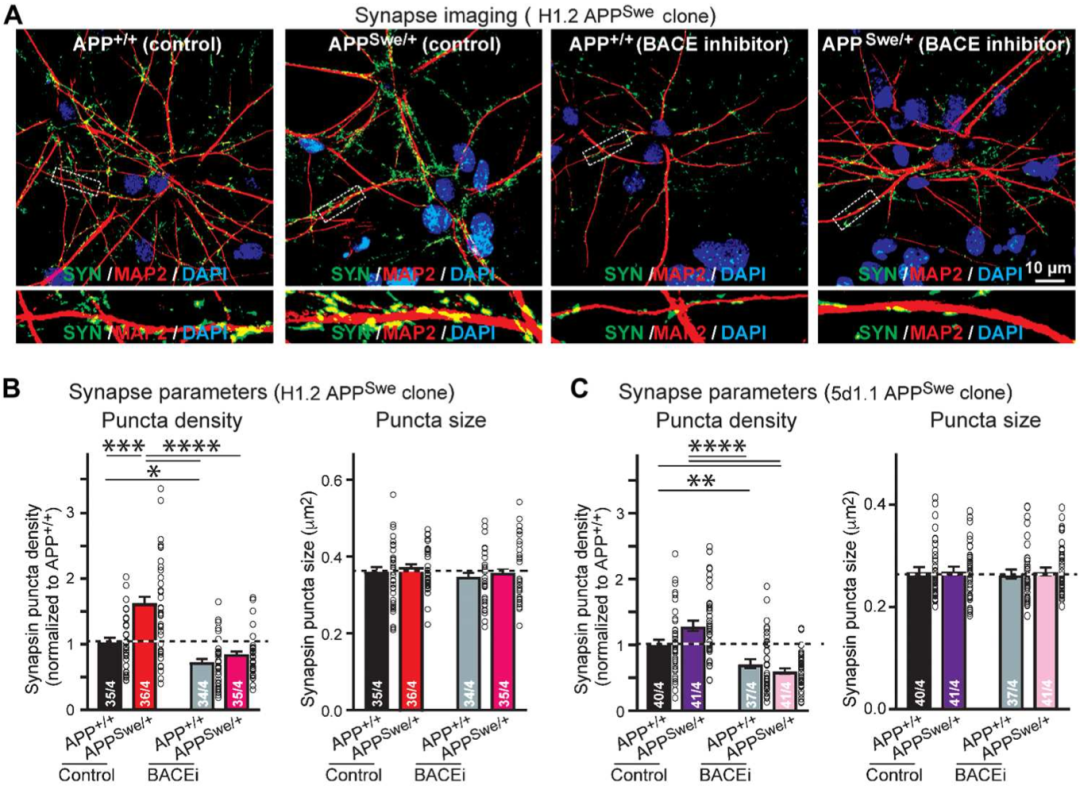
BACE1抑制剂会导致神经元的突触数量减少
与此同时,电生理学实验结果也表明,BACE1抑制剂的加入会导致mEPSC的频率在APP+/+神经元中减少20%,在APPSwe/+神经元减少40%-60%。
如果Aβ产物增加会提升突触的数量,那么APP的缺失就应该有相反的效果。因此Südhof团队对在胚胎干细胞中进行了APP基因的敲除。结果发现敲除了APP基因的神经元突触密度减少了20%-35%,相应的mEPSC频率也减少了20%-30%。由此得出,APP基因的缺失会抑制突触数量的增长和突触功能,而APP的瑞典型突变却有相反的效果。
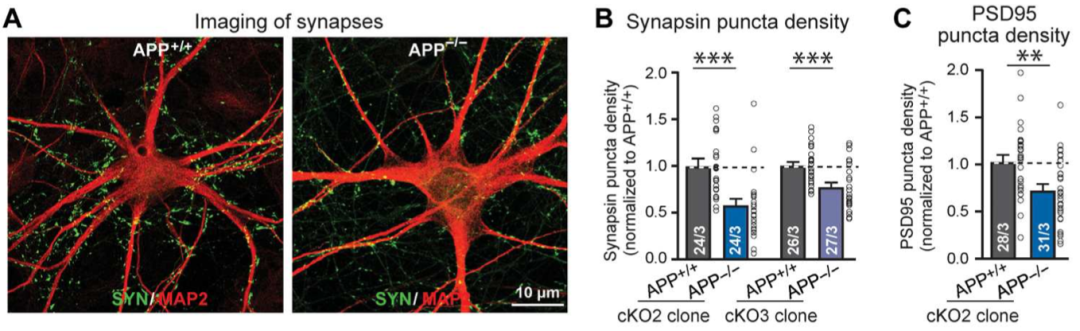
APP缺失的神经元突触密度降低
需要注意的是,由BACE1剪切下来的APP产物并不是唯一的,而这些产物也能够继续分解得到Aβ。通过比较,Südhof团队发现,在APP瑞典型突变的情况下增多,而在APP缺失的情况下减少的产物有三种,它们分别是sAPPβ,C99和Aβ。其中,C99能够水解得到Aβ,而sAPPβ则不能继续水解生成Aβ。
因此为了探究具体是哪一种产物会影响神经元突触的变化,研究人员利用HEK293T细胞表达了APP,sAPPβ和C99,并将它们分别加入APP缺失的神经元和APP+/+神经元中,观察它们对这两种神经元的形态和电生理特性的影响。
ADtaxi 回忆「记」程车vol.21 听伦敦国王学院的药理学教授 彼得·詹纳 解读阿尔茨海默病和帕金森病
结果表明外源性APP和C99的加入,使APP+/+神经元的突触密度增加了25%,也使APP缺失的神经元突触密度增加了25%。电生理学结果也表明两种神经元中的mEPSC频率,在加入了外源性APP和C99后都增加了30%。而加入外源性的sAPPβ的神经元与APP缺失的神经元相比,突触密度并没有显著性增加。
因为在这三种外源性物质中,只有sAPPβ不能产生Aβ,表达外源性APP和C99的细胞的上清液中,都检测到了Aβ浓度的升高。因此这些结果也表明,Aβ可能是影响神经元突触密度和突触连接的关键物质。
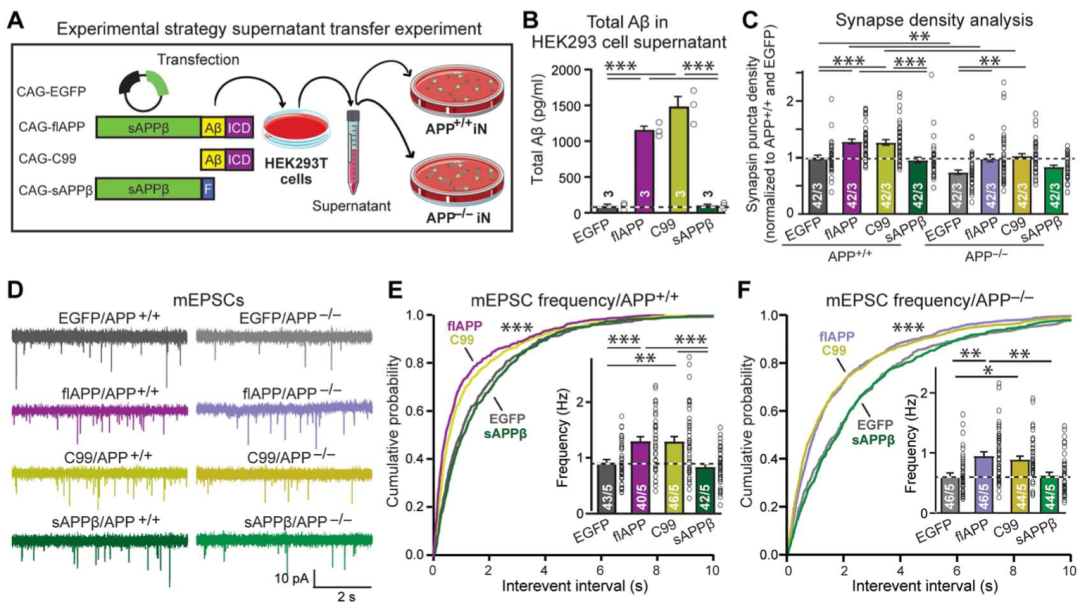
外源性APP和C99的加入可以增加神经元突触密度和mEPSC频率
这项研究的实验结果表明,虽然在长久以来Aβ和APP都被视为造成阿尔茨海默病细胞毒性的关键物质和基因[9,13],但在生理环境下,APP至少能够通过产生Aβ来促进人类神经元突触的形成。
需要指出的是,此前大部分基于Aβ的动物模型都引入了异常高浓度的Aβ,并且因为使用的转基因技术的差异,导致各个模型的基因背景存在差异[14-15],不能够很好地模拟真实疾病状态下的Aβ产物。
对于这一研究结果,有科学家指出不应该曲解为不能清除AD患者大脑中的Aβ聚集物,毕竟一些临床研究已经证实清除Aβ聚集物对AD患者是有益的[16]。
参考文献:
[1] Long JM, Holtzman DM. Alzheimer Disease: An Update on Pathobiology and Treatment Strategies. Cell. 2019;179(2):312-339. doi:10.1016/j.cell.2019.09.001
[2] Knopman DS, Amieva H, Petersen RC, et al. Alzheimer disease. Nat Rev Dis Primers. 2021;7(1):33. Published 2021 May 13. doi:10.1038/s41572-021-00269-y
[3] Hampel H, Vassar R, De Strooper B, et al. The β-Secretase BACE1 in Alzheimer's Disease. Biol Psychiatry. 2021;89(8):745-756. doi:10.1016/j.biopsych.2020.02.001
[4] Salloway S, Farlow M, McDade E, et al. A trial of gantenerumab or solanezumab in dominantly inherited Alzheimer's disease. Nat Med. 2021;27(7):1187-1196. doi:10.1038/s41591-021-01369-8
[5] Henley D, Raghavan N, Sperling R, Aisen P, Raman R, Romano G. Preliminary Results of a Trial of Atabecestat in Preclinical Alzheimer's Disease. N Engl J Med. 2019;380(15):1483-1485. doi:10.1056/NEJMc1813435
[6] Egan MF, Kost J, Voss T, et al. Randomized Trial of Verubecestat for Prodromal Alzheimer's Disease. N Engl J Med. 2019;380(15):1408-1420. doi:10.1056/NEJMoa1812840
[7] Zhou B, Lu JG, Siddu A, Wernig M, Südhof TC. Synaptogenic effect of APP-Swedish mutation in familial Alzheimer's disease. Sci Transl Med. 2022;14(667):eabn9380. doi:10.1126/scitranslmed.abn9380
[8] Citron M, Oltersdorf T, Haass C, et al. Mutation of the beta-amyloid precursor protein in familial Alzheimer's disease increases beta-protein production. Nature. 1992;360(6405):672-674. doi:10.1038/360672a0
[9] Haass C, Lemere CA, Capell A, et al. The Swedish mutation causes early-onset Alzheimer's disease by beta-secretase cleavage within the secretory pathway. Nat Med. 1995;1(12):1291-1296. doi:10.1038/nm1295-1291
[10] Chapman PF, White GL, Jones MW, et al. Impaired synaptic plasticity and learning in aged amyloid precursor protein transgenic mice. Nat Neurosci. 1999;2(3):271-276. doi:10.1038/6374
[11] Wang Z, Jackson RJ, Hong W, et al. Human Brain-Derived Aβ Oligomers Bind to Synapses and Disrupt Synaptic Activity in a Manner That Requires APP. J Neurosci. 2017;37(49):11947-11966. doi:10.1523/JNEUROSCI.2009-17.2017
[12] Sheng M, Sabatini BL, Südhof TC. Synapses and Alzheimer's disease. Cold Spring Harb Perspect Biol. 2012;4(5):a005777. Published 2012 May 1. doi:10.1101/cshperspect.a005777
[13] Gallardo G, Holtzman DM. Amyloid-β and Tau at the Crossroads of Alzheimer's Disease. Adv Exp Med Biol. 2019;1184:187-203. doi:10.1007/978-981-32-9358-8_16
[14] Israel MA, Yuan SH, Bardy C, et al. Probing sporadic and familial Alzheimer's disease using induced pluripotent stem cells. Nature. 2012;482(7384):216-220. Published 2012 Jan 25. doi:10.1038/nature10821
[15] Kondo T, Asai M, Tsukita K, et al. Modeling Alzheimer's disease with iPSCs reveals stress phenotypes associated with intracellular Aβ and differential drug responsiveness. Cell Stem Cell. 2013;12(4):487-496. doi:10.1016/j.stem.2013.01.009
[16]https://www.alzforum.org/news/research-news/cultured-human-neurons-av-spurs-synapse-growth
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


