你是一喝酒就脸红吗?多项研究:喝酒脸红者更易衰老、出现大脑中Aβ病理加重、炎症因子分泌减少等问题,增加阿尔茨海默病发生风险
来源:生物谷原创 2025-06-07 08:57
这些实验结果共同揭示了ALDH2 rs671基因变异者面临的双重打击!
在酒桌上,总能看到这样的画面:有人千杯不醉,谈笑风生;而有人一沾酒,脸就红得像煮熟的虾,多喝几杯甚至会蔓延“红遍全身”。
这种“喝酒就脸红”的现象,在东亚人群中尤为普遍!你知道吗?大约每三位东亚人中,就有一位在饮酒后会出现这种标志性的“亚洲红”。这绝非酒量深浅那么简单,其根源在于我们体内的基因——一种名为ALDH2基因的特定位点突变(ALDH2*2)。这种突变导致关键的乙醛代谢酶(ALDH2)活性大幅降低。
问题来了:乙醛是酒精代谢过程中产生的有毒副产品。当解酒“主力军”ALDH2罢工或怠工,乙醛便无法被有效分解清除。于是,脸红就成了乙醛在体内大量堆积的最直观信号。这意味着,喝酒脸红的人,不仅酒量可能更小,每一次饮酒,身体都在承受着更猛烈的毒性冲击!
关于这一点,在我们往期的推送中曾解读过相关研究:乙醛堆积的危害远不止于脸红心跳。它会加速与人体内的DNA和蛋白质发生反应,形成有害的DPCs(DNA-蛋白质交联物),干扰细胞的正常增殖与功能,加速身体衰老的进程!
然而,更令人担忧的新发现是:这种“解酒基因”的缺陷,可能正悄然威胁着我们的大脑健康!去年,一项发表在Nature Communications的研究显示:携带ALDH2 rs671基因变异(基因型为AA或AG)的喝酒脸红人群,其大脑中出现阿尔茨海默病(AD)关键病理标志——Aβ斑块的数量显著增多,且毒性更强的Aβ42肽比例也更高。接下来,让我们来细细道来~

本研究的实验对象是 469 例来自东亚地区最大脑库——中国国家人类脑库(National Human Brain Bank for Development and Function)的尸检大脑样本。这些样本涵盖了不同ALDH2基因型(GG、GA 和 AA)的个体,为研究提供了丰富的材料。
研究人员对样本进行了详细的病理学分析,包括Aβ斑块沉积、Aβ40和 Aβ42水平等指标的检测,并结合基因测序技术确定了参与者的ALDH2 rs671基因型。
此外,研究还利用了Aldh2基因敲除小鼠和APP/PS1转基因小鼠模型,来模拟人类 AD 的病理特征,验证ALDH2活性对Aβ病理的影响。并且,通过给予小鼠 ALDH2抑制剂(如 daidzin,150 mg/kg/天,持续2个月)处理,研究者观察了其对 Aβ40/42 比例及病理变化的影响,从而揭示了ALDH2活性与Aβ生成之间的联系。
导致喝酒脸红的基因与阿尔茨海默症的联系
研究发现,携带ALDH2 rs671基因变异(正是导致许多人一喝酒就脸红的元凶)的个体,其大脑中AD的标志物Aβ斑块的沉积显著增多。更关键的是,这些个体大脑中的Aβ40/42比例也异常升高(携带AA基因型者风险增加3.35倍,OR:3.35,95% CI:1.25 - 8.98,P = 0.02)。而这个比例的变化,正是预示AD发病风险的重要指标之一。
同时,在APP/PS1小鼠模型中,抑制Aldh2活性显著增加了大脑中Aβ40的水平,并且导致Aβ40/42比例升高(COR 区域 1.48 倍,P < 0.05;Hipp 区域 1.83 倍),这表明Aldh2活性的降低可能加剧Aβ病理。
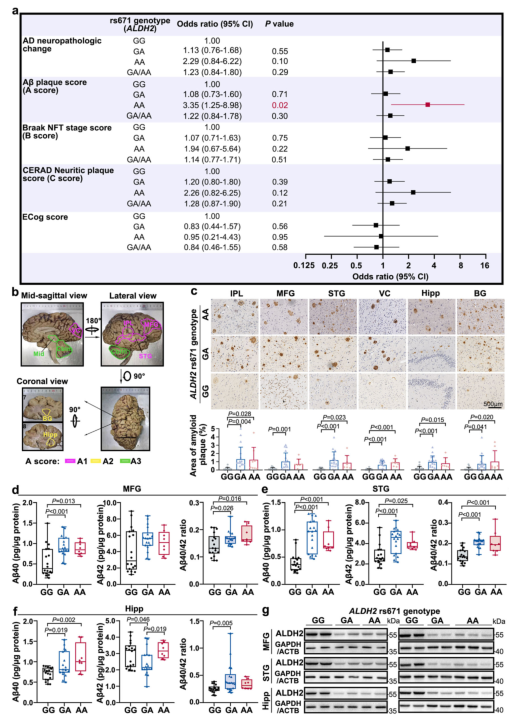
图1. ALDH2 rs671变异与Aβ病理的相关性
那么,这个基因变异是如何撬动AD病理进程的呢?
谜底指向一种危险的代谢物——4-HNE(4-羟基-2-壬烯醛)。研究描绘出一条清晰的分子级联反应:
1. ALDH2活性降低:rs671变异首先导致关键的解毒酶ALDH2功能减弱。
2. 4-HNE蓄积:ALDH2失活使得毒性醛类物质4-HNE(4-羟基-2-壬烯醛)在体内大量堆积。
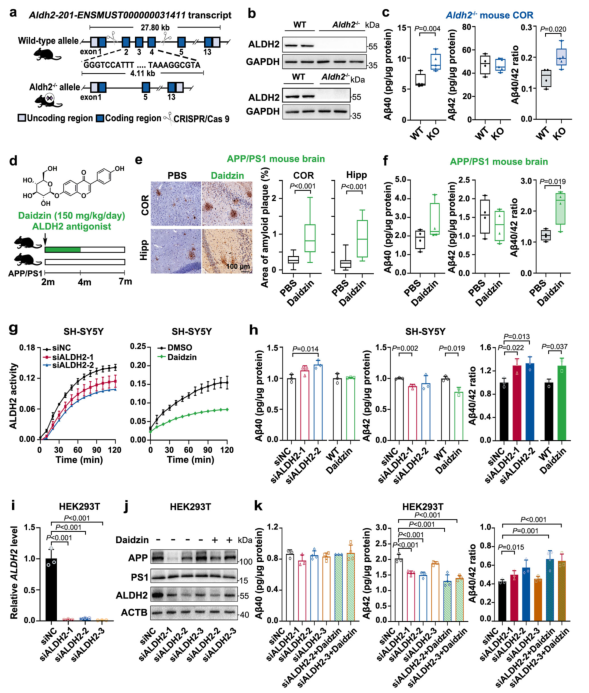
图2. ALDH2活性对Aβ40/42比率的影响
3. 锁定目标蛋白:研究发现4-HNE,特别是其(R)-4-HNE对映体,能够与C99(Aβ前体蛋白的C末端片段)的 Lys53 残基发生席夫碱反应,改变C99的空间结构,使其更倾向于在高尔基体中生成 Aβ40。这种结构变化可能导致Aβ40生成增加,Aβ42生成减少,从而改变Aβ40/42比例。正如下图所示,与天然底物相比,4-HNE修饰的底物使Aβ40/42比例升高了1.47倍!
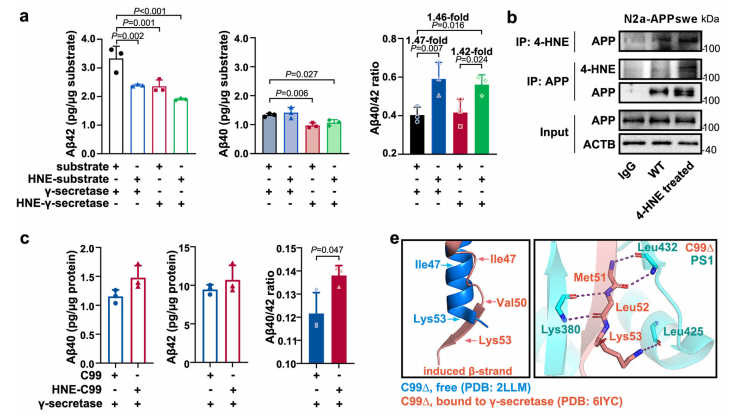
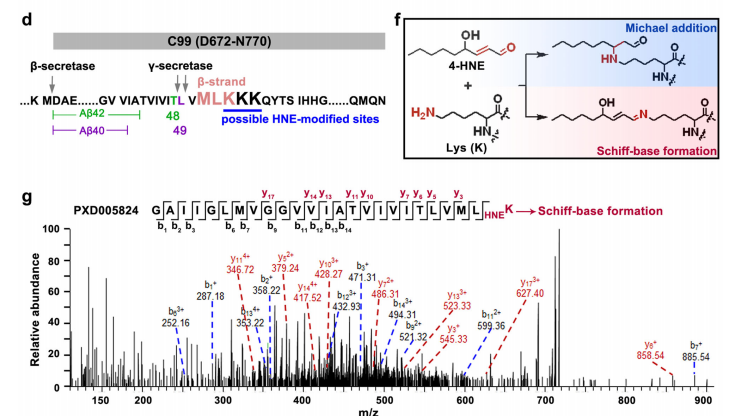 图3.(R)−4-HNE通过与C99的Lys53残基发生共价结合来增加Aβ40/42比例
图3.(R)−4-HNE通过与C99的Lys53残基发生共价结合来增加Aβ40/42比例
4. 运输助力:雪上加霜的是,4-HNE还会驱动APP蛋白更多地滞留在高尔基体,并增强其与分选受体SORL1的相互作用,进一步为Aβ40的“增产”创造条件。它甚至能促进APP从内质网“逆行”返回高尔基体,为这条有害的生产线持续“供料”。
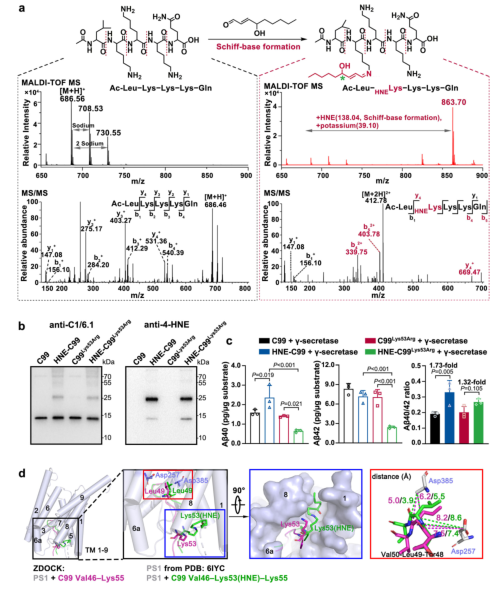
图4.(R)−4-HNE通过席夫碱反应与C99的Lys53残基结合,导致C99的位置发生偏移,进而使Aβ40/42比例增加
更进一步,研究者在APP/PS1小鼠模型中人为抑制Aldh2活性。他们完美复刻出了上述的理论流程:小鼠大脑中Aβ40水平飙升,Aβ40/42比例显著升高(特定脑区升高1.48-1.83倍,P < 0.05),为上述分子机制提供了强有力的活体验证。
然而,危害远不止于此。ALDH2功能的缺失,还悄然瓦解了大脑的“清道夫”防线——小胶质细胞。
研究发现,在BV2小胶质细胞模型中,一旦ALDH2活性被削弱,这些免疫细胞吞噬清除Aβ的能力便急剧下降。这表明ALDH2活性降低可能通过影响小胶质细胞的功能,加剧Aβ在大脑中的积累和扩散。
更令人忧心的是,在Aβ斑块周围巡逻并试图将其“围剿”的微胶质细胞数量也明显减少。这一关键免疫防御功能的崩溃,在接受ALDH2抑制剂治疗的APP/PS1小鼠以及携带rs671变异的AD患者大脑中都得到了印证:斑块周围小胶质细胞聚集不足,伴随着Aβ斑块更肆无忌惮地扩散。
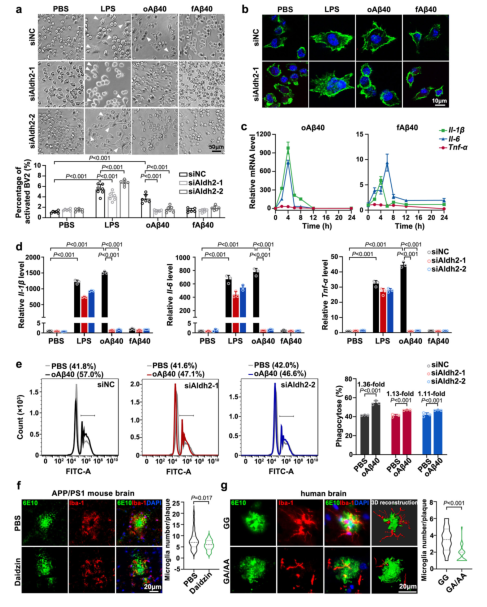
图5. ALDH2活性降低对小胶质细胞功能的影响
小结
综上所述,这些实验结果共同揭示了ALDH2 rs671基因变异者面临的双重打击:
● 分子层面:通过4-HNE蓄积,直接“改写”Aβ前体蛋白的加工规则,导致毒性更强的Aβ40过量产生和Aβ40/42比例失衡。
● 细胞层面:削弱大脑最重要的“清道夫”小胶质细胞的功能,使其无力清除不断堆积的Aβ“垃圾”。
因此,喝酒易脸红的朋友们请注意了,为了自己的大脑健康,还是尽可能少喝酒吧!
参考文献:
Wang X, Wang J, Chen Y, et al. The aldehyde dehydrogenase 2 rs671 variant enhances amyloid β pathology. Nat Commun. 2024;15(1):2594. Published 2024 Mar 22. doi:10.1038/s41467-024-46899-0
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


