PD-1抑制剂单药让局部晚期dMMR直肠癌实现100%完全缓解!11项ASCO LBA 再袭
来源: 奇点糕 2022-06-10 13:25
万万没想到的是,都2022年了,有一种少见的恶性肿瘤竟然才开展了第一个随机对照临床试验。好消息是,这个研究成果有望改写这个癌症的治疗规则。
万万没想到的是,都2022年了,有一种少见的恶性肿瘤竟然才开展了第一个随机对照临床试验。好消息是,这个研究成果有望改写这个癌症的治疗规则。
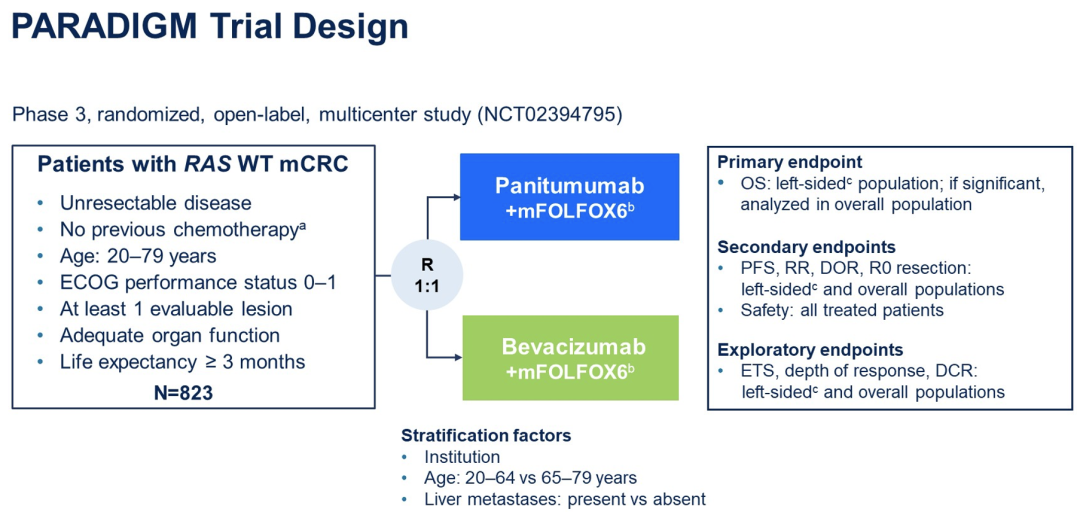
LBA1-帕尼单抗(PAN)联合mFOLFOX6对比贝伐珠单抗(BEV)联合mFOLFOX6,作为RAS野生型(WT)转移性结直肠癌(mCRC)患者的一线治疗:来自3期PARADIGM试验的结果
PARADIGM是第一个对RAS野生型(WT)转移性结直肠癌(mCRC)和左侧原发性肿瘤患者进行帕尼单抗(PAN)对比贝伐珠单抗(BEV)联合标准双重一线化疗优越性的前瞻性试验。
日本研究者进行的这一开放标签、多中心试验(NCT02394795),随机选择了未接受过化疗的RAS WT mCRC患者,分配至PAN + mFOLFOX6或BEV + mFOLFOX6方案治疗。总生存率(OS)作为主要终点,分别在左侧原发肿瘤和全分析集(FAS)的患者中进行测算。关键次要终点包括无进展生存期(PFS)、缓解率(RR)和根治性切除率(R0)。
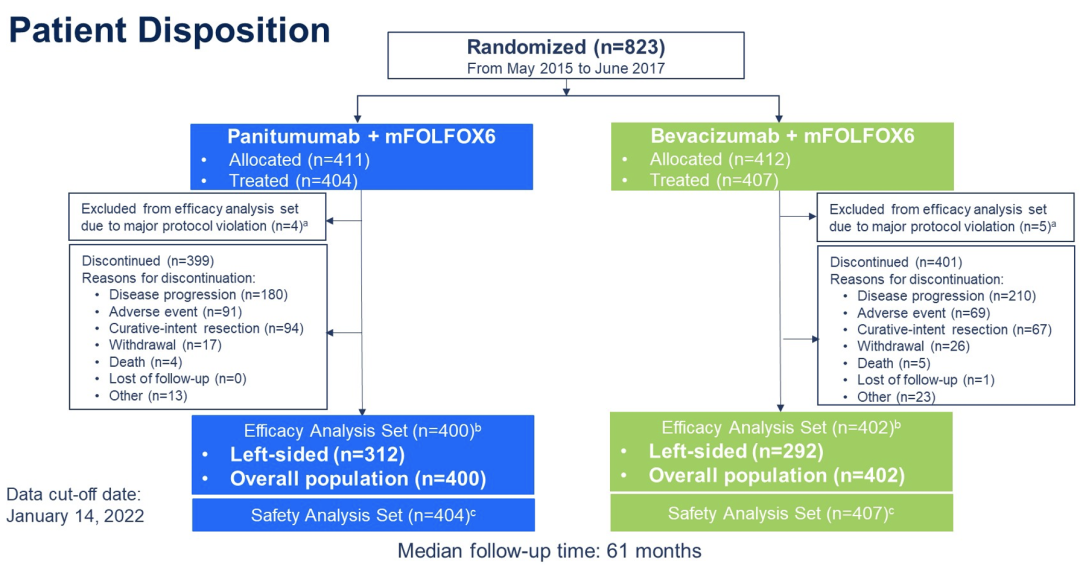
2015年5月至2017年6月,823例患者被随机分组;12例未接受方案治疗,9例因严重偏离纳入标准而被排除。在FAS人群,共有400例患者接受PAN,402例患者接受BEV;分别有312例和292例患者为左侧原发性肿瘤。在中位随访61个月后,448例左侧原发肿瘤患者发生了OS事件,从而进行OS分析。
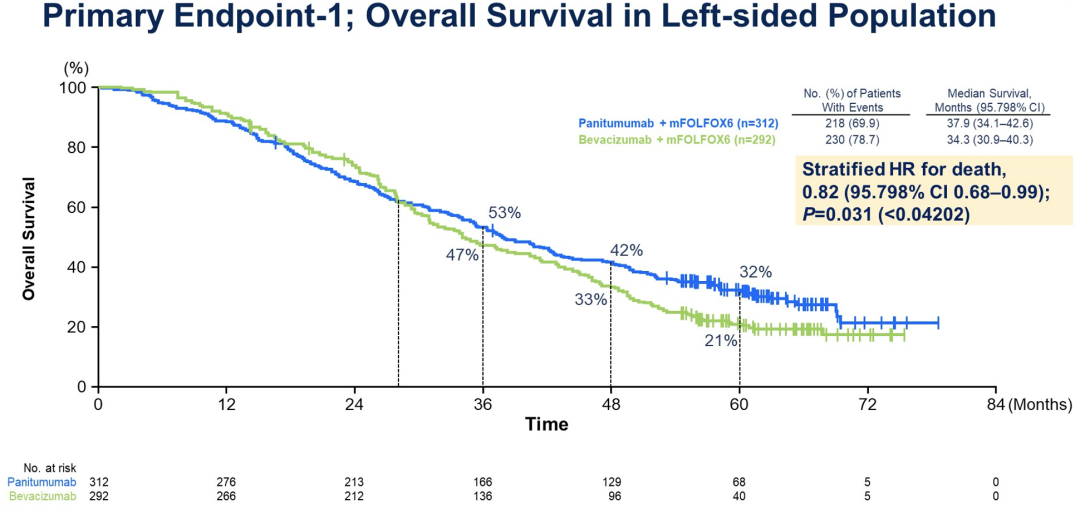
与BEV相比,PAN在两个人群中显著改善OS:左侧原发肿瘤人群的风险比(HR)为0.82[95.798%CI,0.68-0.99,p =0.031,越过显著性界限(0.042)],FAS人群的HR为0.84(95%CI,0.72-0.98;p =0.030,以<0.05为界)。虽然PFS在两组间相似,但PAN组的RR和R0切除率均高于BEV组。右侧原发肿瘤人群中OS的HR为1.09。没有观察到新的安全性事件。
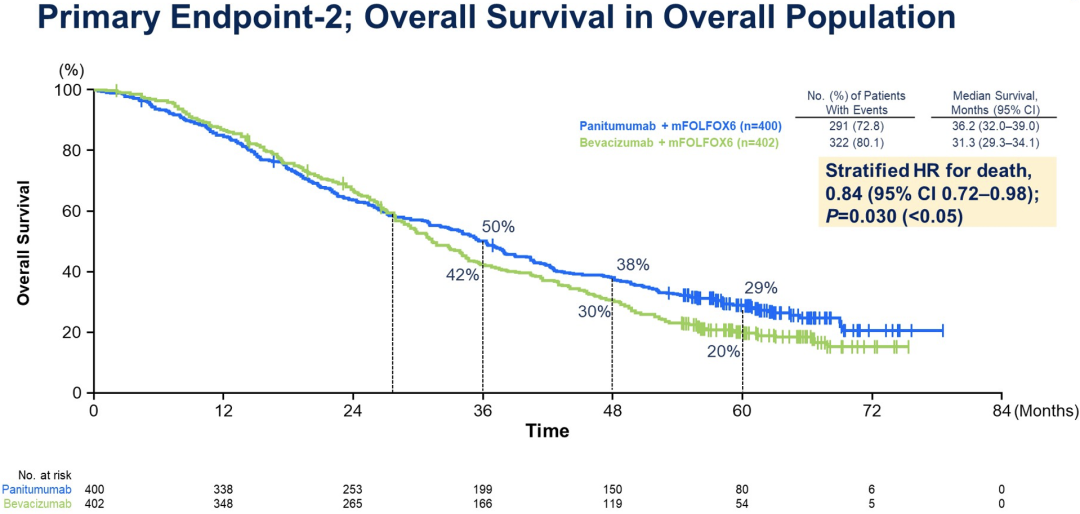
与BEV相比,PAN联合mFOLFOX6显著改善RAS WT和左侧原发肿瘤mCRC患者的OS,为该人群建立了标准的一线联合方案。
LBA2-评估拓扑替康、环磷酰胺和大剂量异环磷酰胺,用于治疗复发和原发难治性尤文肉瘤(RR-ES)的国际随机对照3期临床研究(rEECur)
RR-ES患者的5年生存率约为15%。rEECur是第一个有关于RR-ES治疗的随机对照试验,旨在定义标准治疗方案,同时权衡疗效和毒性。
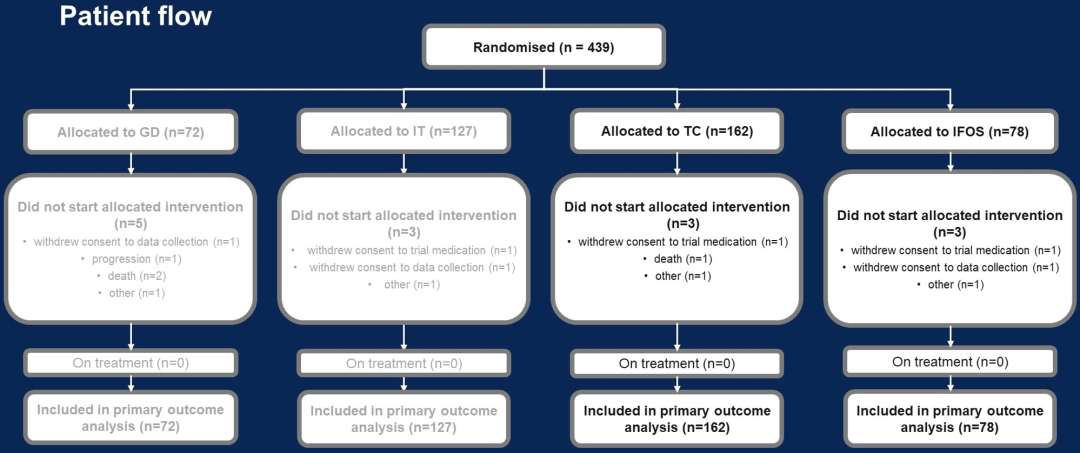
来自曼彻斯特大学的研究人员将4-50岁的RR-ES患者随机分到拓扑替康+环磷酰胺组(TC组)、伊立替康+替莫唑胺组(IT组)、吉西他滨+多西他赛组(GD组)或大剂量异环磷酰胺组(IFOS组)。研究的主要终点是3期研究中的无事件生存期(EFS),次要终点包括总生存期(OS)、毒性和生活质量(QoL)。基于概率论的贝叶斯算法被用于多个成对比较。在第一次和第二次中期评估中,发现被分配到GD和IT组的患者的客观缓解(OR)和EFS比其他组更差,因此中止了这两组的患者招募。最终的意向治疗分析即是对TC和IFOS疗效比较的3期研究。

从2014年12月18日至2021年8月31日,这个研究共纳入451例患者,其中TC组163例,IT组127例,GD组72例,IFOS组83例。患者的中位年龄为19岁(4-49)。患者中难治性的占18%,首次复发的占66%,非首次复发的占17%。疾病首发部位为骨骼的占70%。疾病的进展情况为:仅原发部位(15%),仅胸膜肺转移(34%),存在其他部位转移(51%)。患者的基线肾功能相似。患者中位随访时间(反向Kaplan-Meier法)为40月。
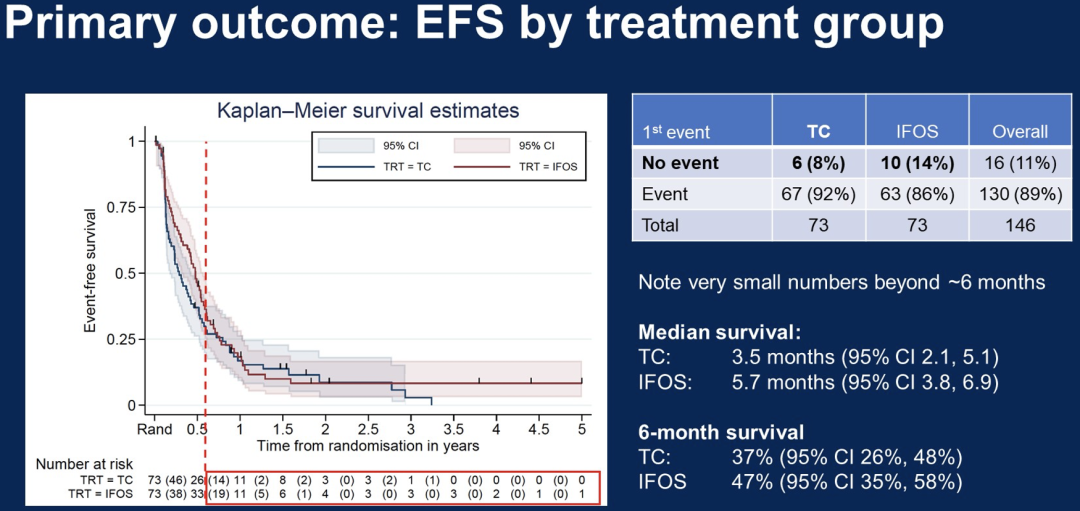
对于TC组和IFOS组(均为73例患者)的比较显示,TC组和IFOS组的中位EFS分别为3.7月和5.7月,中位OS分别为10.4月和16.8月。从数据来看,IFOS治疗后EFS和OS优于TC治疗的后验概率均为95%。在EFS和OS方面,14岁以下的患者比≥14岁的患者有更大的生存差异。亚组分析在所有最小化因素中都显示IFOS疗效更好。
与IFOS相比,TC的主要3/4级不良事是:发热性中性粒细胞减少症(26% vs 25%)、感染(8% vs 14%)、呕吐(1% vs 1%)、恶心(0% vs 3%)、腹泻(1% vs 1%)、脑病(0% vs 7%)和肾毒性(0% vs 8%)。生活质量评分的描述性统计显示:在儿童中,IFOS组好于TC组,但在成年人中则不然。
总的来看,RR-ES的第一个随机试验表明,大剂量异环磷酰胺在延长生存期方面比TC更有效,当然也优于GD和IT。如果其他药物与IFOS联合使用是合理的,那么在今后的有关RR-ES的随机2/3期研究中,IFOS应该被视为对照治疗。rEECur是第一项评估RR-ES中四种最常用化疗方案的毒性和生存数据的临床研究。
LBA4-来那度胺、硼替佐米和地塞米松(RVd)±自体干细胞移植(ASCT)和R维持到进展,治疗新诊断多发性骨髓瘤(NDMM)的3期试验(DETERMINATION试验)
在符合移植条件的NDMM患者中,三联/四联诱导、ASCT和基于R的维持治疗的最佳方案仍在探索中。
2009年的IFM试验中使用R维持治疗1年,显示RVd+ASCT相比于仅使用RVd,其无进展生存期更长(中位PFS:35.0月 vs 47.3月),但总生存率并没有改善(第8年OS:60% vs 62%;中位随访89.8月),在该研究中,复发时有多个治疗选择,首次复发时77%的患者选择ASCT治疗(Attal M等,N Engl J Med 2017;Perrot A等,ASH 2020)。在此次ASCO会议上,来自丹娜法伯癌症研究所的研究团队报告了DETERMINATION试验的初步结果,该试验中维持R治疗直到疾病进展。
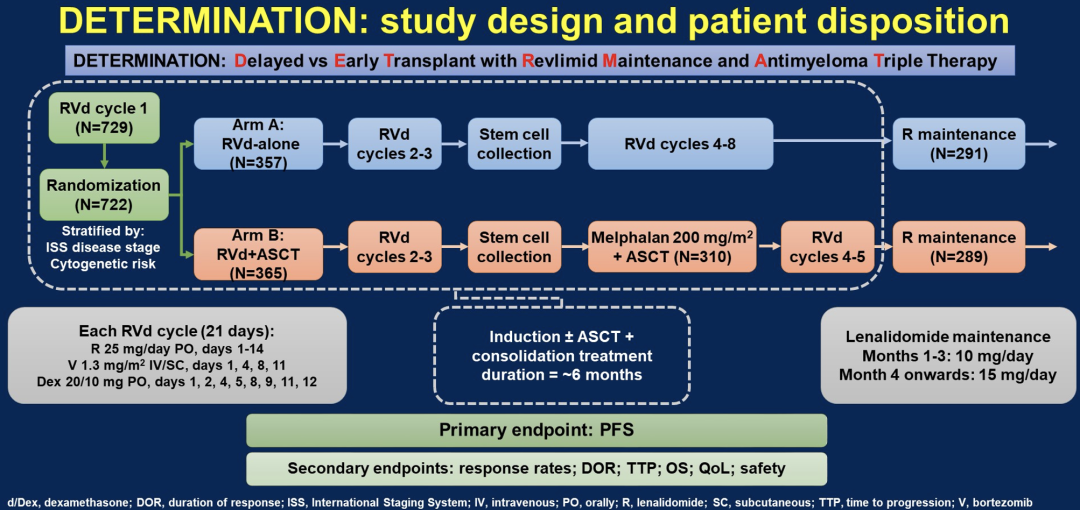
年龄18-65岁的NDMM患者被随机分到A组(3周期RVd治疗,干细胞动员,5周期RVd治疗)或B组(静脉注射马法兰200 mg/㎡+ ASCT和2周期RVd)。每个21天的RVd周期包括口服R 25 mg(d1~14),静脉注射/皮下注射V 1.3 mg/㎡(d1,4,8,11),口服地塞米松20/10 mg(1-3周期≥4次;d1,2,4,5,8,9,11,12)。两组患者均接受R 10-15 mg/d维持治疗,直至病情进展或无法耐受。研究的主要终点是无进展生存期(PFS)。数据截止日期为2021年12月10日。
最终,这个研究共纳入722例患者,其中A组357例,B组365例,两组患者的中位年龄分别为57岁和55岁,ISS III期MM患者分别占14%和13%,高危细胞遗传学患者分别占18%[t(4;14),t(14;16),del17p]。在两组中,291和290例患者接受了R维持治疗,中位持续时间分别为36月和41月。
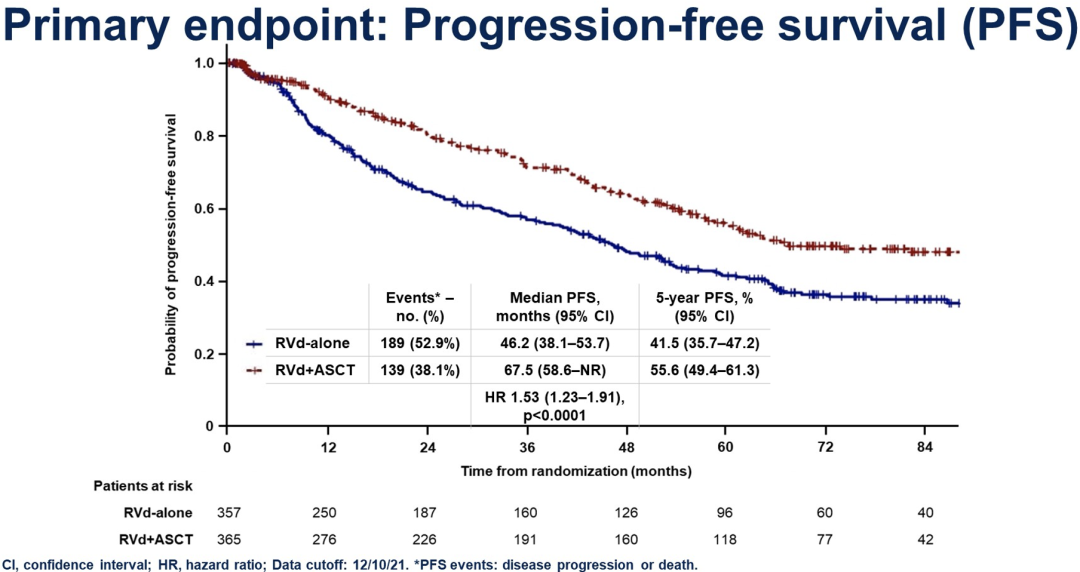
在中位随访76月及出现328个事件后,A组和B组的中位PFS分别为46.2月和67.6月(HR 1.53;95%CI,1.23-1.91;p<0.0001)。
到目前为止,两组患者最佳疗效为52% vs 62%(≥CR, p=0.006),79% vs 83%(≥VGPR)和94% vs 96%(≥PR)。在251例可评估的患者中,维持1年内MRD阴性率(10-5)为37.3% vs 52.1%(p=0.021)。两组中,分别有63%和53%的患者接受了后续治疗。在A组患者中,22%的患者将ASCT作为第一次非试验治疗。A组与B组死亡病例分别为90例和88例,4年OS分别为84%和85%(HR:1.10,p=0.274)。
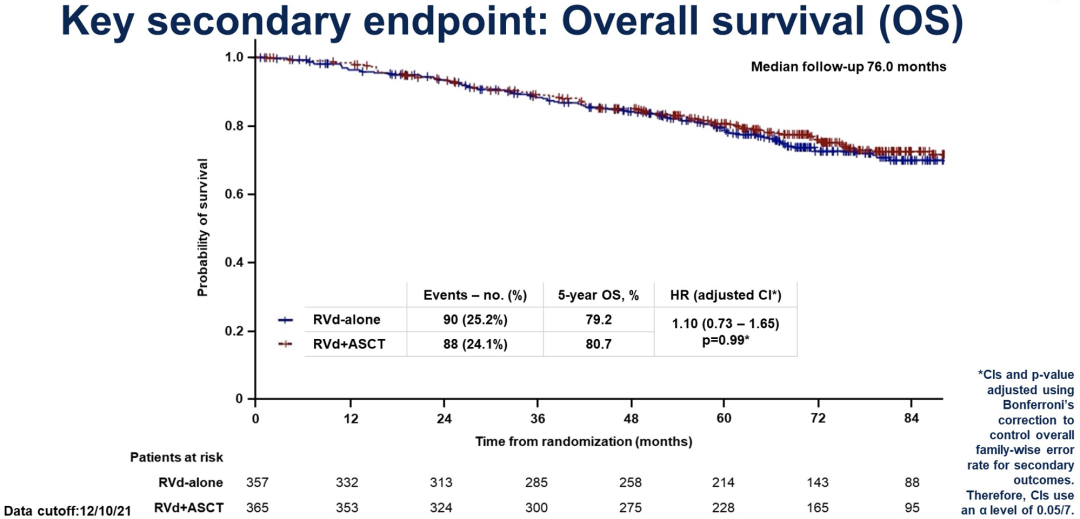
≥3级的不良事件A组比B组较少(78% vs 94%;血液学不良事件:61% vs 90%,p<0.0001)。两组中分别有10%和11%的患者患继发性恶性肿瘤(ALL,7例 vs 3例,p=0.22;AML/MDS,0例 vs 10例,p=0.002)。在整个治疗过程中,除了在RVd第5个周期与ASCT后(依从率:75% vs 55%;平均变化+3.0 vs -11.1;p<0.0001),EORTC QLQ-C30健康状况评分的平均变化与基线的差异小于10分。全基因组测序、额外的生活质量和相关分析正在进行中。
总的来看,RVd±ASCT和R维持治疗到进展使得每种方法达到了所报道过的最长的中位PFS,而使用RVd+ASCT的中位PFS获益非常显著地增加了21.4月。到目前为止还没有观察到OS的获益。
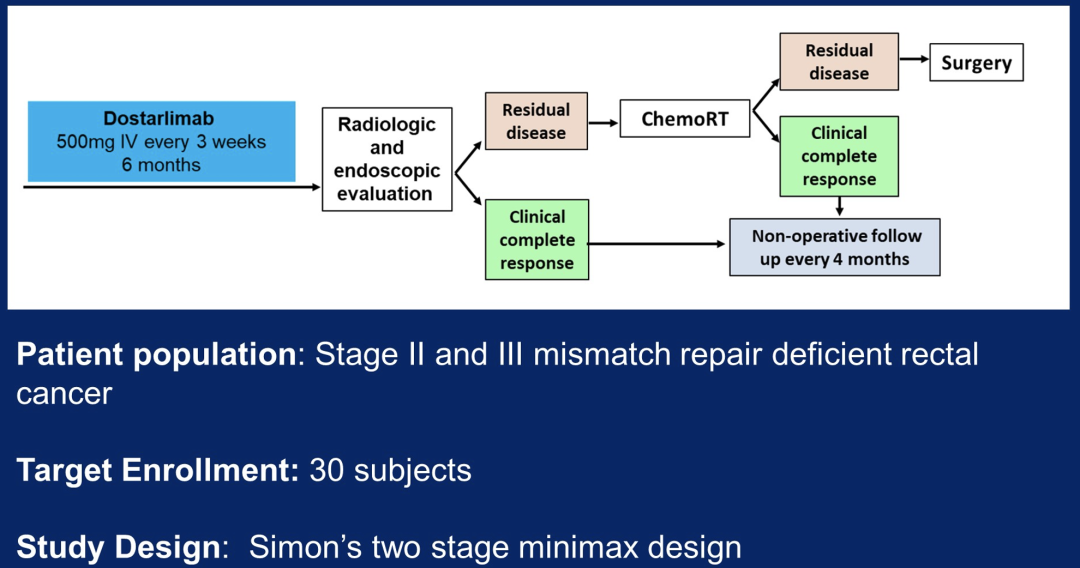
LBA5-PD-1抑制剂单药作为错配修复缺陷局部晚期直肠癌的根治性治疗
新辅助化疗和放疗后进行直肠手术切除是局部晚期直肠癌的标准治疗。错配修复缺陷是直肠癌的一个亚群。
由于错配修复缺陷转移性结直肠癌对PD-1阻断剂有反应,美国纽约Memorial Sloan Kettering肿瘤中心的Andrea Cercek研究团队假设局部晚期错配修复缺陷直肠癌对免疫检查点抑制剂可能敏感,并可能改变放化疗和手术的要求。
该团队进行了一项前瞻性II期研究,使用PD-1抑制剂dostarlimab,每3周一次给药治疗II期和III期错配修复缺陷直肠腺癌患者,持续6个月,随后进行标准的放化疗和手术。达到临床完全缓解的患者可以免去放化疗和手术。
12例患者开始了治疗,并进行至少6个月的随访。所有12例患者(100%,95%CI,74%-100%)均达到临床完全缓解,在MRI、FDG-PET、电子可视化内镜、直肠指检或活检均无肿瘤迹象,这满足了本研究的共同主要终点。
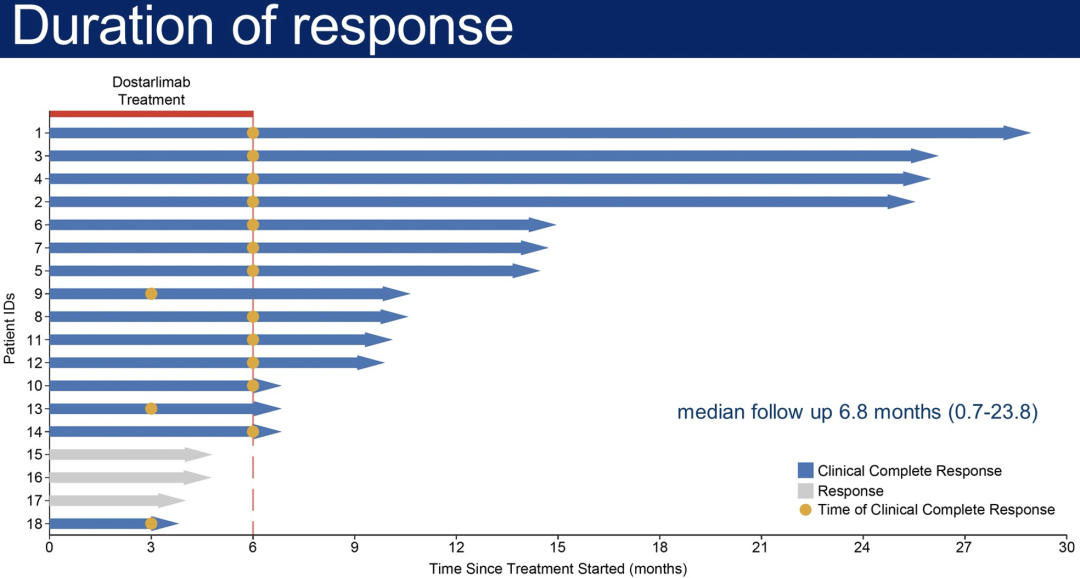
迄今为止,在随访期间(范围6-25个月)没有患者需要放化疗或手术,也没有发现进展或复发的病例。未观察到大于3级的严重不良事件。
错配修复缺陷局部晚期直肠癌对PD-1抑制剂单药治疗异常敏感。需要更长的随访时间来评估缓解持续时间。
LBA511-TX05-03e-在经新辅助治疗和手术切除的HER2阳性早期乳腺癌中,比较曲妥珠单抗生物类似药候选物(TX05)与原研曲妥珠单抗辅助治疗的安全性、疗效以及免疫原性的一项研究。
TX05为正在开发的曲妥珠单抗生物仿制药。之前的研究已报道了一项在HER2阳性早期乳腺癌(EBC)患者中比较TX05与原版曲妥珠单抗(TRA)疗效和安全性的III期临床研究(TX05-03)的结果。在TX05-03研究中,接受TX05治疗的受试者与接受TRA的患者相比,病理完全缓解率在预设的等效范围内,该结果支持TX05具有和TRA相等的疗效。本延申研究,进一步评估和阐述了TX05和TRA单药治疗的安全性,免疫原性和疗效。
TX05-03e研究是一项III期随机双盲,平行设计临床试验。该研究在10个国家的82个中心招募患者。患者接受单药曲妥珠单抗(TX05或TRA)辅助治疗,3周治疗为1周期,治疗最长不超过13个周期。新辅助治疗阶段接受TX05的受试者,辅助阶段继续接受TX05,而在新辅助治疗阶段随机接受TRA的受试者,随机(1:1)接受TX05或TRA辅助治疗。
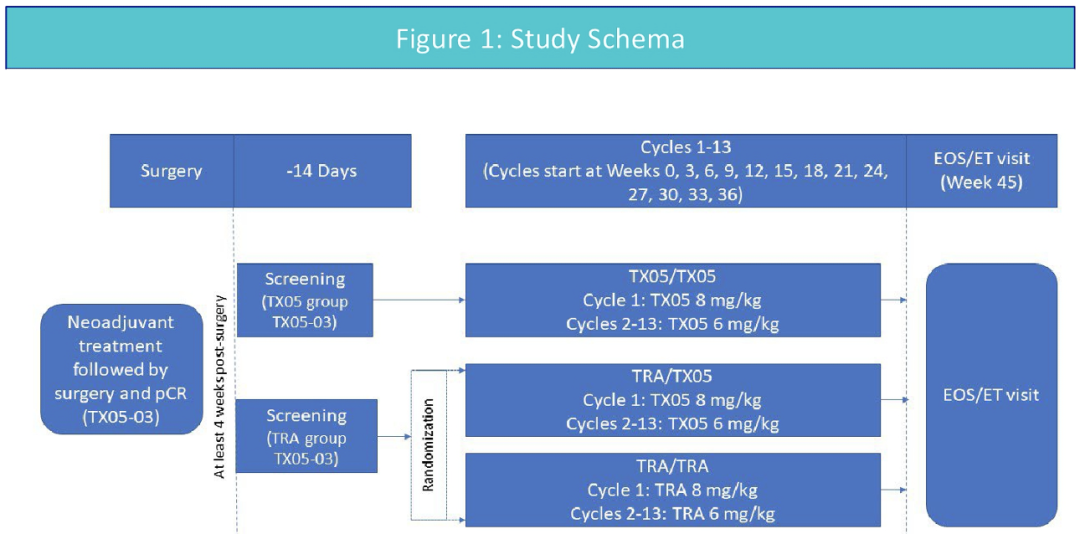
疗效终点包括无病生存(DFS)和总生存(OS)。DFS定义为从新辅助治疗(方案TX05-03)随机分组到首次失败记录的时间。OS被定义为从新辅助治疗随机分组到任何原因导致的死亡的时间。安全性参数包括治疗相关不良事件(TEAE)和严重不良事件(SAE),死亡,临床实验室参数,生命体征,12导联心电图,LVEF和体格检查。研究还评估了免疫原性。
在随机分组的338名受试者中,256名接受TX05治疗,82名接受TRA治疗。81例接受TX05治疗的患者在新辅助治疗阶段接受TRA治疗。三组受试者的人口统计学和基线特征平衡良好(新辅助/辅助治疗阶段的TX05/TX05,TRA/TRA或TRA/TX05)。研究有一例受试者死亡(由于疾病进展,TRA/TX05组)。DFS事件发生率较低,TX05/TX05组的,TRA/TRA组的6.1%和TRA/TX05组的发生率分别仅为3.4%、6.1%和3.7%。
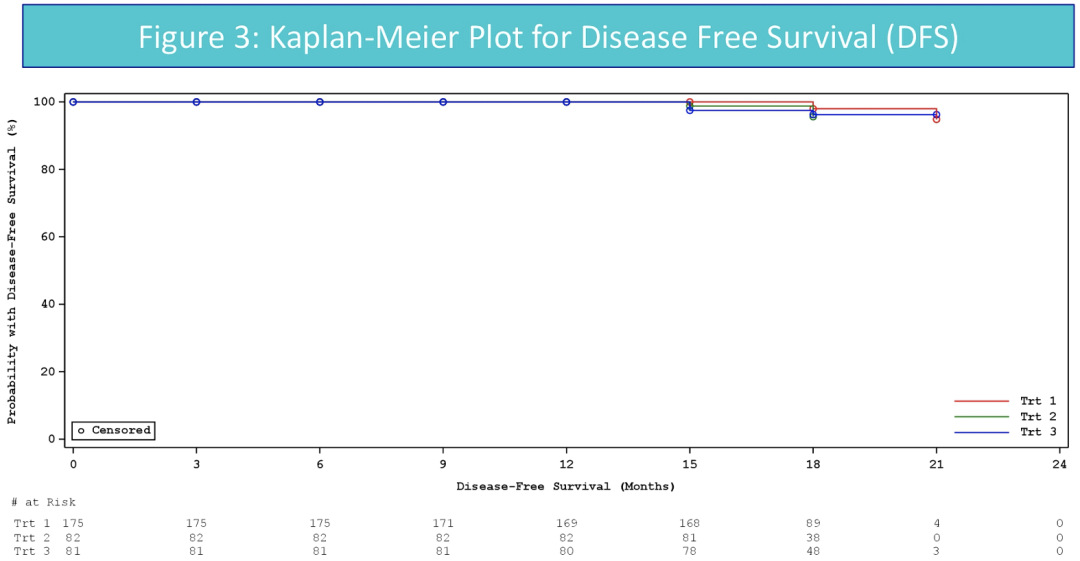
三组中发生全部等级AE受试者的数目分别为,TX05/TX05中53.1%,在TRA/TRA组中56.1%,TRA/TX05组37%。三组与研究药物相关的不良事件发生频率,类型和严重程度相似,未检测到新的安全性信号。
随机接受TX05/TX05,TRA/TRA或TRA/TX05新辅助/辅助治疗的受试者,其DFS,OS,AEs和免疫原性相当,该结果进一步支持TX05与其参考产品具有生物类似性。辅助治疗中,由TRA更换至TX05对患者的安全性或疗效没有可检测到的影响。
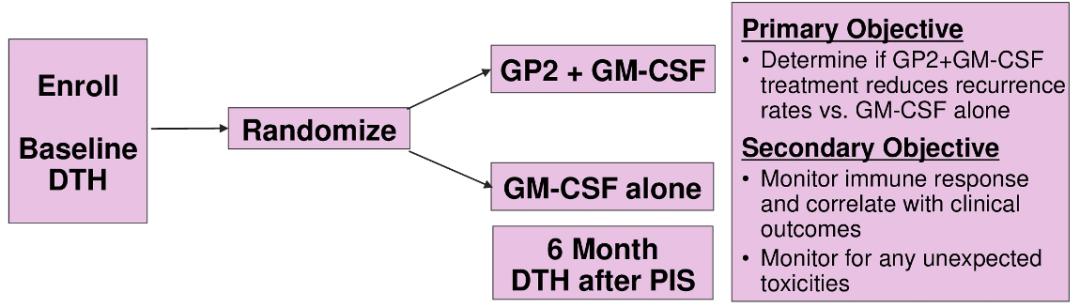
LBA550-评估HER2/neu多肽GP2(GLSI-100)与单用GM-CSF,在HER2阳性乳腺癌患者曲妥珠单抗辅助治疗后,增强注射维持峰值免疫力的2b期研究
在GLSI-100(GP2+GM-CSF)的2b期随机、主动对照、单盲、多中心试验中,对HER2阳性的淋巴结转移阳性和高危淋巴结阴性乳腺癌患者,分析了增强注射的注射部位反应(ISR)。与安慰剂相比,GLSI-100安全地激发了强大的免疫反应,同时数据显示ISR与免疫反应[如迟发型超敏反应(DTH)]相关。
参与这个研究的患者随机接受GLSI-100(500 mcg GP2 : 125 mcg GM-CSF)或GM-CSF治疗,作为初级免疫系列(PIS)的一部分,每3-4周皮内注射6次,持续6个月,此后每6个月增强注射4次。注射后48-72小时评价注射ISR。增强注射是在试验中期引入的,因此并不是所有的患者都进行了增强注射。测量硬结的最大直径,并计算正交平均值以量化ISR,提供PIS和增强期免疫高峰和谷点的潜在评估方式。
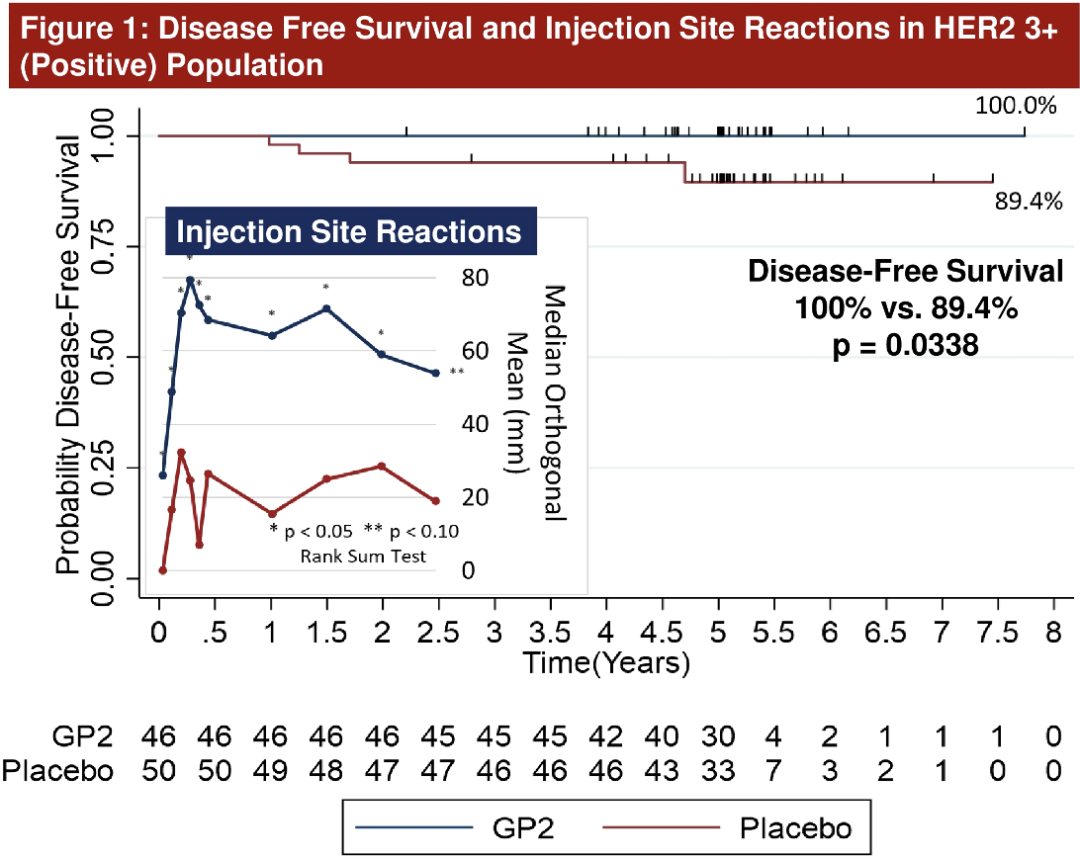
这项研究最终纳入了180名HER2 3+阳性和HER2低表达(1-2+)的患者。经过5年随访,GLSI-100治疗的46例HER2 3+患者的5年无病生存率(DFS,Kaplan-Meier法估计)为100%,而GM-CSF治疗的50例患者的5年DFS率为89.4%(P=0.0338)。如果患者在前6个月内接受治疗、随访并保持无病,则该患者属于有效人群。
53例(54%)HER2 3+患者接受了增强治疗。GLSI-100组PIS期间ISR的中位数峰值为92.1 mm,而GM-CSF组仅为60.5 mm。在接受GLSI-100治疗的患者中,ISR峰值出现在整个10剂注射期间,包括在增强剂注射期间。在6剂PIS期间,84%的峰值ISR发生在3-6剂之间。每次增强注射是在最后一次注射后6个月给药,因此增强注射ISR可能是衡量最低免疫应答的指标。当比较PIS期间与增强注射的峰值ISR时,增强注射的谷点ISR大约小了20 mm。
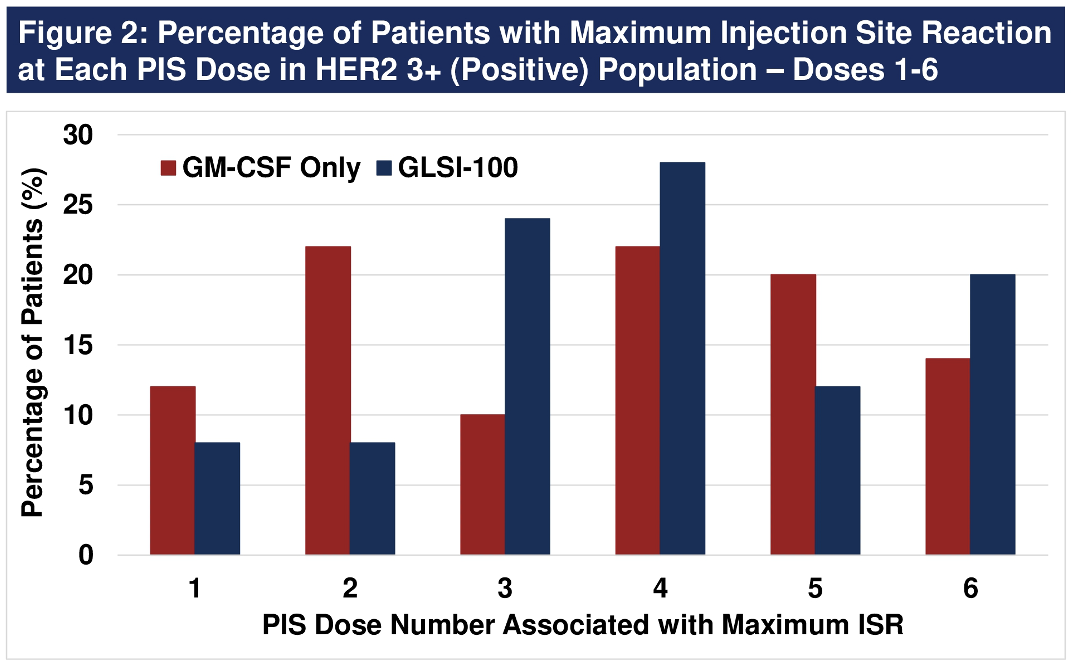
总的来看,每隔6个月给予GLSI-100增强剂的患者产生一致的最低值ISR,比PIS的最大值92.1 mm小约20 mm,但仍大于仅使用GM-CSF的患者的最大值60.5 mm。从理论上讲,患者在注射增强剂一个月后的免疫反应将导致峰值ISR,这将在未来的试验中通过测量增强剂注射后一个月的T细胞反应和DTH来衡量,从而进一步帮助评估增强注射策略,以在更长的时间内保持峰值免疫力。
LBA2002-达拉非尼联合曲美替尼(dab+tram)治疗携带BRAF V600突变儿童低级别胶质瘤(pLGG)2期临床试验的初步分析
LGG是儿童最常见的脑肿瘤,而其中约17%的病例携带有BRAF V600突变。大多数pLGG患者需行手术治疗,但在术后仍需进行后续治疗,通常是行化疗,如卡铂+长春新碱(C+V),然而这种方案对携带BRAF V600突变的患者效果较差。因此,对于这部分患者,需要替代治疗方案。
dab+tram在1/2期研究(NCT02124772)中,对于先前治疗过的BRAF V600突变pLGG患者显示出令人鼓舞的疗效。在此次会议,来自日本的学者汇报了在BRAF V600突变pLGG患者中比较dab+tram与C+V作为一线治疗疗效的随机2期临床试验(NCT02684058)的结果。
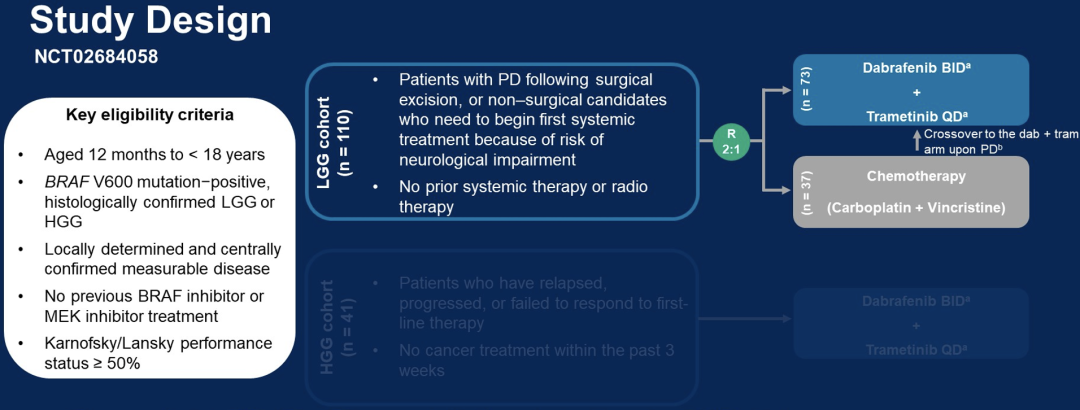
该研究纳入了1-<18岁、携带BRAFV600突变、Karnofsky/Lansky评分≥50%的脑胶质瘤患者。在pLGG患者中,手术后因疾病进展或非手术治疗而需要系统治疗的患者被随机(2:1)分配到接受dab(<12岁,5.25 mg/kg/d;≥12岁,4.5 mg/kg/d)+tram组(<6岁,0.032 mg/kg/d;≥6岁,0.025 mg/kg/d)或C+V(标准剂量)组。研究的主要终点是总体缓解率(ORR,独立审查,RANO标准),次要终点包括研究者评估的ORR、临床受益率(CBR)、缓解持续时间、起效时间、无进展生存期(PFS)、总生存期和安全性。
研究总共纳入110例患者,其中dab+tram组73例,C+V组37例,C+V组有4例患者在治疗前退出。两组基线特征相似。截止2021年8月23日,患者中位随访18.9月,dab+tram组有61例(84%)仍在接受治疗,C+V组有8例(22%);C+V组有9例完成计划治疗,16例在完成之前停止治疗。
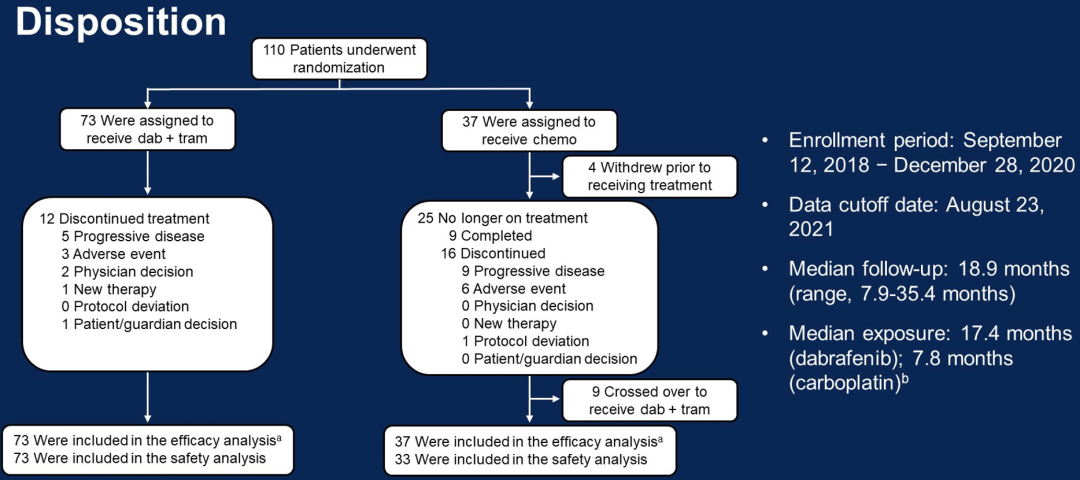
dab+tram组独立评估的ORR(CR+PR)为47%,而C+V组为11%(P<0.001;优势比:7.2),临床受益率(CR+PR+SD≥24周)dab+tram组为86%,C+V组为46%。
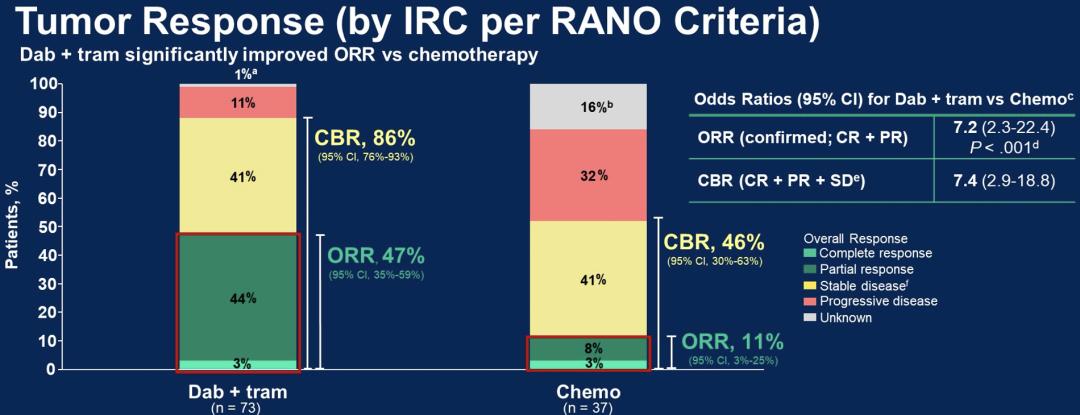
dab+tram组中位PFS为20.1月,C+V组为7.4月(P<.001;HR:0.31),12个月Kaplan-Meier法计算所得PFS率为67%(dab+tram组)对26%(C+V组)。
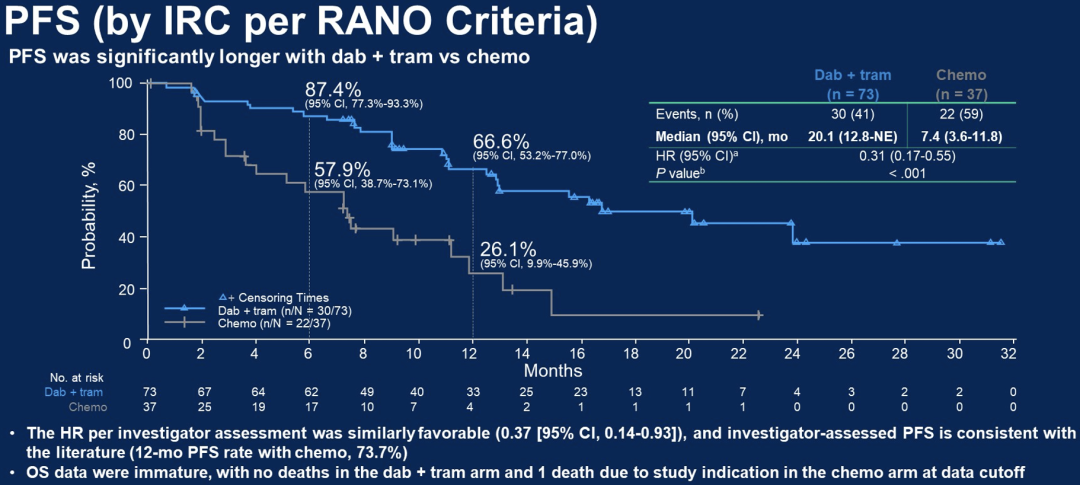
dab+tram组无患者死亡,C+V组有1例患者因LGG死亡。与C+V组相比,dab+tram组患者的≥3级不良事件(AE)更少(47% vs 94%),由于AE而中止治疗的患者也更少(4% vs 18%)。相比C+V组,dab+tram组最常见的不良反应是发热(68% vs 18%)、头痛(47% vs 27%)和呕吐(34% vs 48%)。
与C+V方案相比,dab+tram显著改善了携带BRAF V600突变pLGG患者的ORR和CBR,并延长了PFS。这些令人鼓舞的结果和可耐受的安全性表明,dab+tram可能是这类患者有效的一线系统治疗方案。
LBA3025-Trastuzumab deruxtecan联合其他抗癌药物在晚期/转移性HER2+(Destination-Breast07 [DB-07])和HER2-Low(Destination-Breast08 [DB-08])乳腺癌患者中的剂量探索和扩展研究
Trastuzumab deruxtecan(T-DXd)是一种抗体偶联药物,由人源化的抗HER2单抗和拓扑异构酶I抑制剂组成,已被批准用于先前经≥2次抗HER2治疗的不可切除或转移性HER2+乳腺癌患者。
在3期试验DESTINY-Breast03中(Cortes J, et al. Ann Oncol. 2021),与trastuzumab emtansine(T-DM1)相比,T-DXd作为HER2+转移性乳腺癌患者的早期治疗,可改善无进展生存期。在第1阶段的DS8201-A-J101试验中(Modi S, et al. J Clin Oncol. 2020),T-DXd在HER2-Low晚期/转移性乳腺患者中展现出初步抗肿瘤活性。法国研究团队报道了两项研究T-DXd联合其他抗癌药物治疗HER2+或HER2-low转移性乳腺癌剂量探索阶段的初步结果。
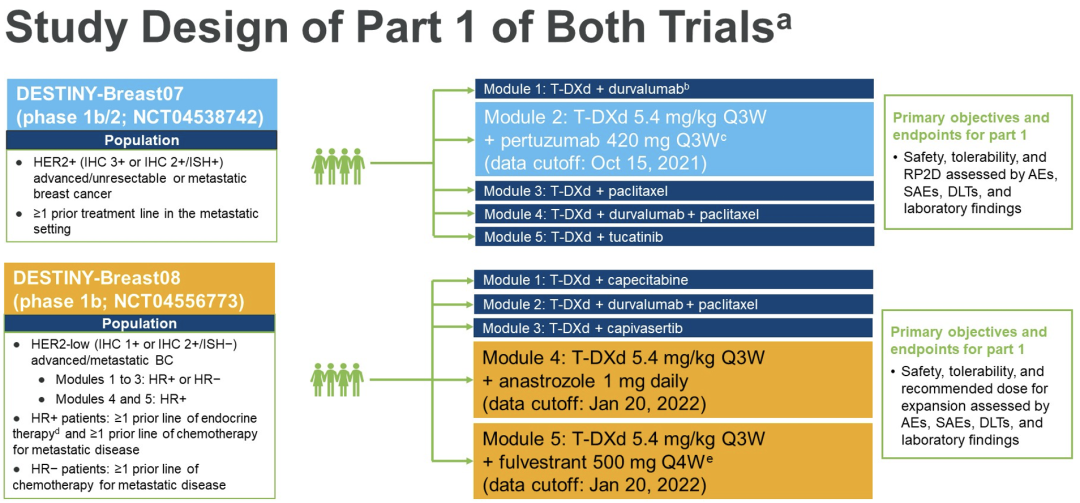
DB-07(1b/2期;NCT04538742)和DB-08(1b期;NCT04556773)是研究T-DXd联合其他抗癌药物治疗HER2+(DB-07)或HER2 low(DB-08)的开放标签、多中心临床试验。每项研究的第一部分都是一个正在进行的剂量探索阶段,患者必须是先前已经经过至少1次治疗的转移性乳腺癌患者。每项研究的第二部分是剂量扩展阶段,患者必须为未接受过治疗(DB-07)或最多接受过1次治疗(DB08)的转移性乳腺癌患者。

此次会议报告了DB-07第一部分(数据截止日期:2021年10月15日)T-DXd+帕妥珠单抗和DB-08第一部分(数据截止日期:2021年9月27日)T-DXd+阿那曲唑和T-DXd+氟维司群的初步结果。DB-08中的患者必须是激素受体阳性。第一部分的主要目标是评估安全性和耐受性,并根据改进的毒性概率区间-2算法确定推荐的第二阶段剂量(RP2D)。患者在21天的剂量限制毒性(DLT)期(T-DXd+氟维司群为28天)后进行安全事件的随访。
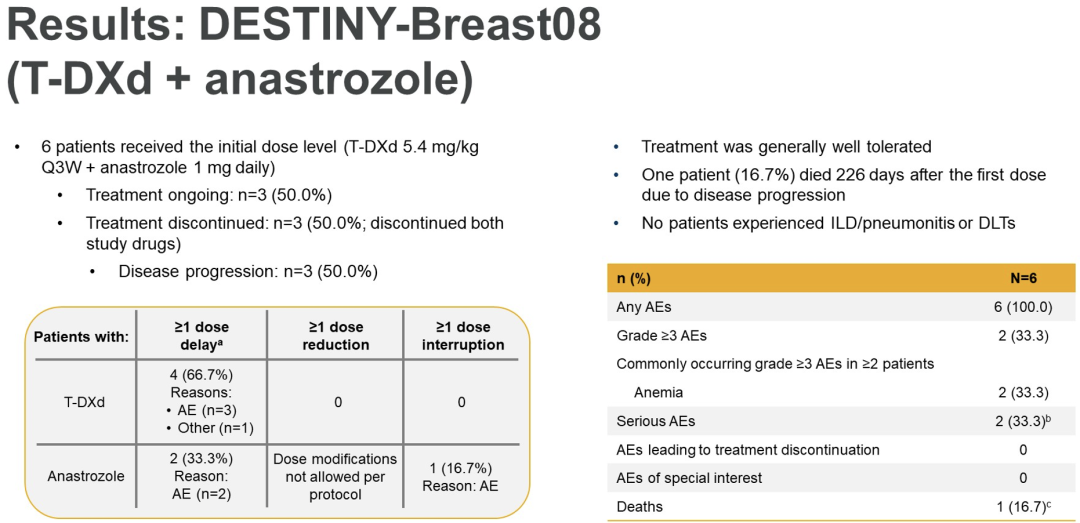
在DB-07中,7例患者接受T-DXd 5.4 mg/kg+帕妥珠单抗 420 mg(负荷剂量:840 mg),每3周1次(q3w;不能用于评估DLT,n=1)。在DB-08中,6例患者接受T-DXd 5.4 mg/kg q3w+阿那曲唑 1 mg/d(不能用于评估DLTS,n=1),另6例患者接受T-DXd 5.4 mg/kg q3w+氟维司群500 mg,每4周一次(负荷剂量:500 mg周期1,第1天和第15天)。对于所有3个队列,在任何可评估DLT的患者中均未发现DLT。第一部分中使用的剂量水平被批准用于每个队列剂量扩展部分的RP2D。到目前为止,没有因研究而死亡或患间质性肺病/肺炎病例的报告。

T-DXd联合用药的RP2D是每种药物乳腺癌的标准剂量。这些研究正在进行中,更多的T-DXd联合用药组合正在评估中,进一步的后续研究正在进行中。
LBA3505-改良FOLFOXIRI联合panitumumab(mFOLFOXIRI/PAN)对比mFOLFOX6/PAN,作为不可切除RAS和BRAF野生型转移性结直肠癌(mCRC)患者的初始治疗:Gruppo Oncologico del Nord-Ovest(GONO)发起的III期随机TRIPLETE研究结果
双药化疗(FOLFOX/FOLFIRI)联合抗EGFR单克隆抗体(西妥昔单抗或panitumumab)是治疗RAS和BRAF 野生型(wt)转移性结直肠癌(mCRC)患者的首选方案。三药联合的FOLFOXIRI方案与抗EGFR组合的II期研究,采用较低剂量的5FU和伊立替康时,报告了亮眼的抗肿瘤活性和可接受的安全性。当在分子选择的人群中与靶向药物结合时,加强前线化疗的附加价值尚未确定。
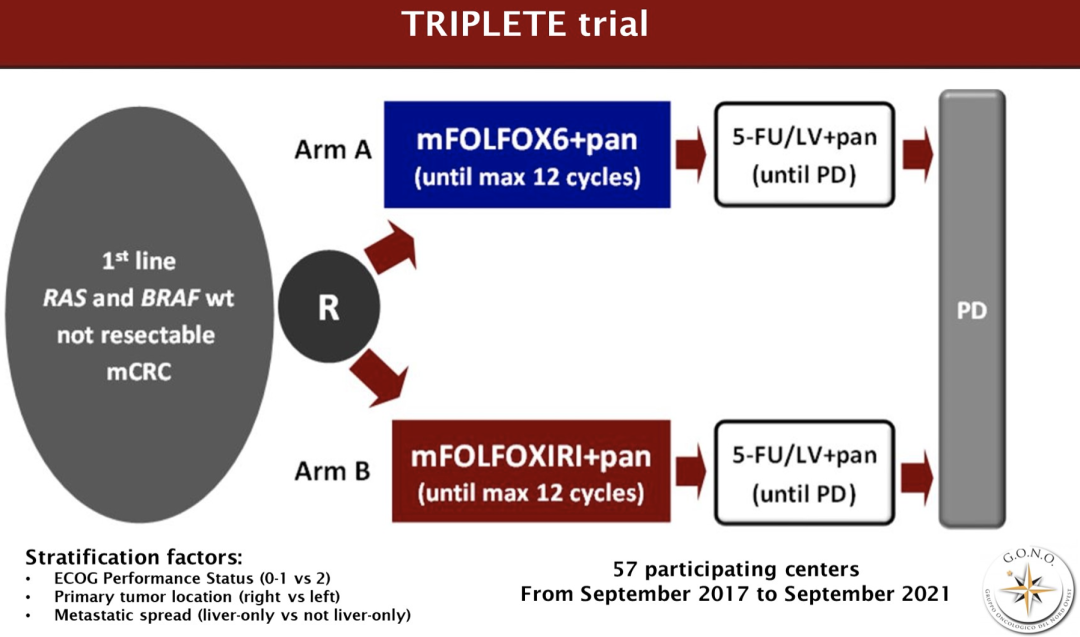
TRIPLETE是一项前瞻性、开放标签、III期试验,既往未治的不可切除RAS和BRAF wt mCRC患者随机接受mFOLFOX6/pan(A组)或mFOLFOXIRI(伊立替康150 mg/sqm,奥沙利铂85 mg/sqm,亚叶酸钙200 mg/sqm,5-氟尿嘧啶2400 mg/sqm,48h输注)/pan(B组)治疗12个周期,然后接受5FU/LV/pan治疗,直至疾病进展。
根据实体瘤疗效评价标准(RECIST)1.1评估主要终点总缓解率(ORR)。次要终点包括安全性、R0切除率、无进展生存期(PFS)和总生存期(OS)。假设A组的ORR为60%,为了检测B组至少15%的增加,432例病例的样本量具有80%的检测效能,使异质性双侧卡方检验在0.05的显著性水平。
从2017年9月至2021年9月,在67个意大利研究中心入组435例患者(A组/B组:217/218)。主要患者特征为(A组/B组):中位年龄59/59,ECOG PS 0 80%/84%,左侧原发肿瘤88%/88%,同时性转移88%/87%,既往辅助治疗2%/6%,切除原发灶43%/51%,仅肝转移37%/39%。大于2级的主要不良事件为腹泻7%/23%,口腔炎7%/7%,中性粒细胞减少症20%/32%,发热性中性粒细胞减少症3%/6%,疲劳2%/7%,皮疹29%/19%。B组218例患者中的160例(73%)和A组217例患者中的165例(76%)达到RECIST评价的缓解[比值比(OR)0.87,95%CI 0.56-1.34,p=0.526]。
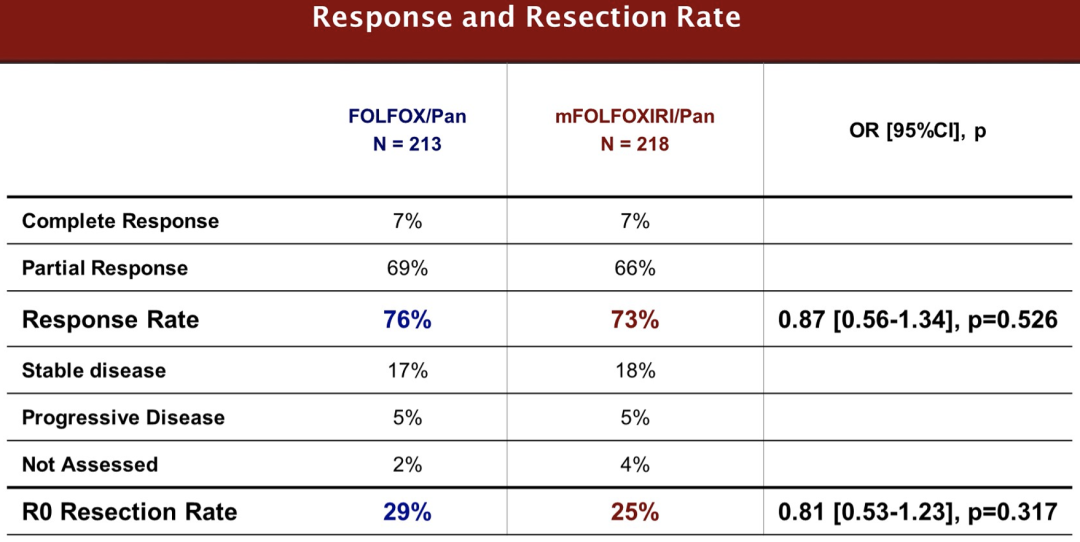
治疗组与病灶转移之间没有明显的相互作用(仅限肝脏转移 vs 非仅肝脏转移)。早期肿瘤缩小(A组/B组:58%/57%,p=0.878)和缓解深度(中位A组/B组:47%/48%,p=0.845)没有差异,R0切除率也没有差异(A组/B组:29%/25%,p=0.317)。在中位26.5个月的随访中,收集了305例(A组/B组:157/148)PFS事件,两组之间无显著差异[中位PFS:12.7 vs 12.3个月,风险比(HR)0.88,95%CI 0.70-1.11,p=0.277]。
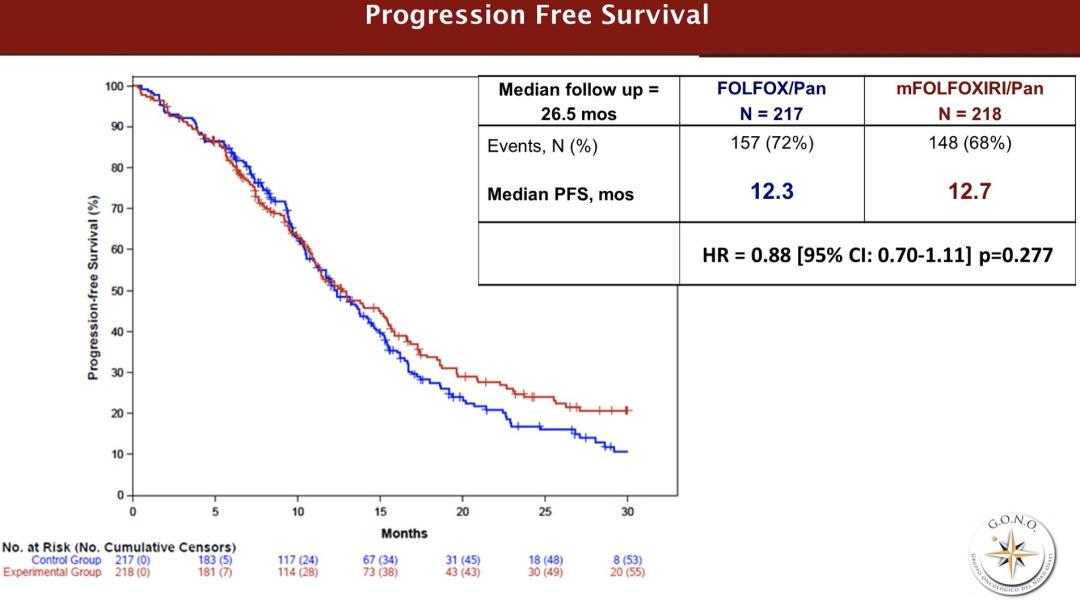
在经分子选择和大多数(88%)左侧原发肿瘤的mCRC患者中,加强前期化疗与帕尼单抗的联合并不能提供任何抗肿瘤疗效的益处,其代价是不可忽略的胃肠道毒性增加。
LBA3506-FOLFOXIRI + 贝伐珠单抗和FOLFOX/FOLFIRI +贝伐珠单抗,在初始不可切除结直肠癌肝转移(CRLM)和右侧原发和/或RAS/BRAF V600E突变原发肿瘤患者中的比较:荷兰结直肠癌组发起的III期CAIRO5研究
初始不可切除结直肠癌肝转移(CRLM)患者在通过系统诱导治疗缩小体积后,可能有机会接受根治性局部治疗。CAIRO5研究旨在找到最佳的诱导方案,荷兰乌德勒支大学医学中心Cornelis J. A. Punt团队展示了右侧原发和/或RAS/BRAF V600E突变原发性肿瘤患者的研究结果,研究的左侧原发肿瘤和RAS/BRAF V600E野生型肿瘤患者正在招募中。
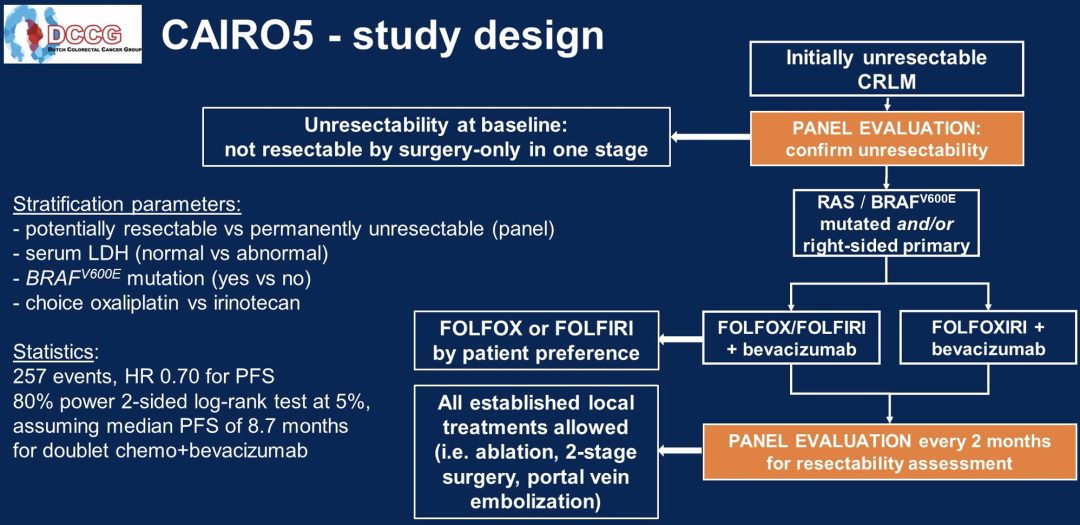
随机分配患者至FOLFOX或FOLFIRI+贝伐珠单抗(B)(A组)和FOLFOXIRI-B(B组),两组均治疗12个周期,然后5FU/LV/B维持治疗。不允许既往对转移灶的系统或局部治疗。基线时CRLM的不可切除性由外科医生和放射科医生组成的在线肝脏专家小组根据预先确定的标准进行评估,此后每2个月根据小组多数投票评估可切除性。
主要终点是无进展生存期(PFS)。次要终点是R0/1切除率、总生存率、总缓解率(ORR)、毒性、病理缓解、术后并发症以及小组评估与预后的相关性。根据潜在可切除与肯定不可切除的CRLM、血清LDH(正常/异常)、BRAF V600E突变状态、副作用、伊立替康与奥沙利铂的选择和研究所对患者进行分层。假设A组的中位PFS为8.7个月,为了检测PFS的风险比(HR)为0.70有80%的效能和5%的双侧对数秩检验,需要257个PFS事件。
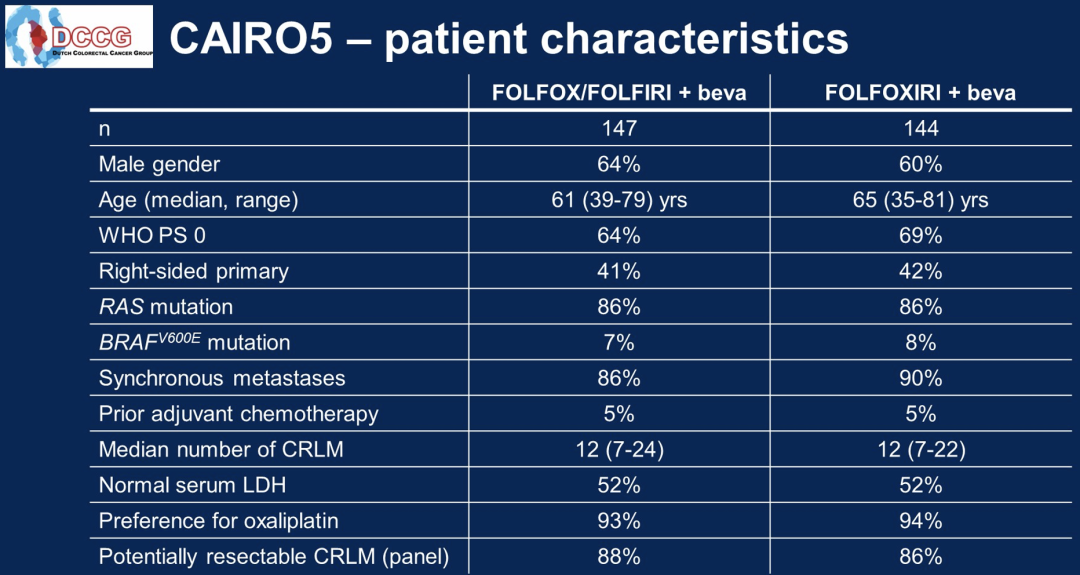
从2014年12月至2021年3月,294例患者被随机分组,其中A组148例,B组146例,分布在43个荷兰和1个比利时的研究中心。排除了3例不合格的患者。中位随访40个月。在A组和B组中,患者接受的诱导周期中位数分别为10个和9个。主要特征为(A组/B组):中位年龄61/65岁,男性63.9%/60.4%,右侧原发肿瘤39.5%/41.7%,RAS突变85.7%/86.1%,BRAF V600E突变6.8%/8.3%,同时性转移86.4%/89.6%,既往辅助化疗4.8%/4.9%,CRLM中位数12/12。在259起事件中,A组和B组的中位PFS分别为9.0和10.6个月(分层风险比为0.74,95%CI 0.57-0.96,p=0.02)。
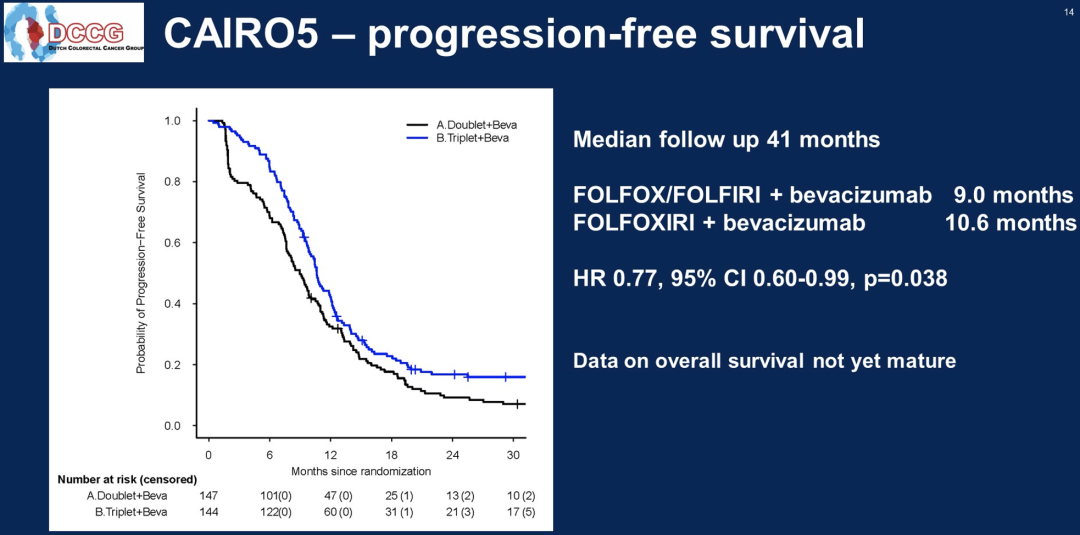
ORR为32.0% vs 52.1%(p<0.001),任何≥3级的不良事件发生率为58.5% vs 75.0%(p=0.003),最常见的是中性粒细胞减少症(12.9%/38.2%,p<0.001),高血压(14.3%/13.9%,p=1)和腹泻(3.4%/19.4%,p<0.001)。R0/1切除±消融率为37.4% vs 51.4%(p=0.02),2期手术为16.4% vs 32.4%(p=0.04),术后并发症发生率为38.2% vs 51.2%(p=0.14),Clavien Dindo分级≥3级为14.7% vs 26.8%(p=0.08)。
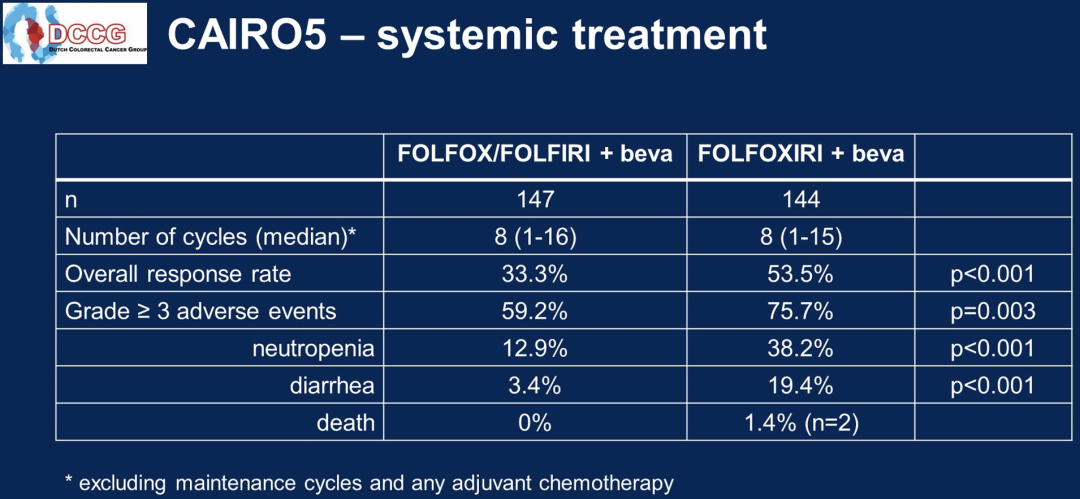
与FOLFOX/FOLFIRI-B相比,FOLFOXIRI-B显著增加了PFS、ORR和R0/1切除率,代价是增加了初始不可切除的CRLM和右侧和/或RAS/BRAF V600E突变原发肿瘤患者的毒性。
LBA3507-对比伴同时性不可切除转移的结肠癌患者,在系统性治疗前切除原发肿瘤与不切除的随机临床试验
系统化疗提高了无法根治性治疗的IV期结肠癌患者的生存率。然而,在化疗前切除原发肿瘤是否能进一步延长这些患者的生存期仍有争议。德国Mannheim大学医院Nuh N. Rahbari研究团队报告了SYNCHRONOUS和CCRe-IV试验的联合结果,比较了IV期结肠癌患者原发肿瘤切除后系统化疗与单纯系统化疗的疗效。

SYNCHRONOUS试验(ISRCTN30964555)是一项采用两组平行设计的多中心、随机、对照、优效性研究。患有同时性不可切除转移的结肠癌患者可以入组。排除标准为有原发性肿瘤相关症状、不能耐受手术和/或系统化疗以及其他原发肿瘤史。根据参与机构的标准进行原发肿瘤切除和系统化疗。
主要终点是最短随访36个月的总生存率(OS)[意向性治疗(ITT)人群]。中期分析得出合并的中位生存时间为18个月。假设中位生存期相差6个月(15个月vs 21个月),双侧I型误差为5%,检测效能为80%,需要额外招募15%,总样本量为n=392例患者(每组n=196例)。为了加快主要终点的报告速度,对西班牙CCRe-IV试验(NCT02015923)的数据进行了汇总,这两项试验采用了相似的入组标准、干预措施和研究终点。

2011年9月至2013年3月,393例患者在100个中心被随机分为化疗前原发肿瘤切除术组(PTR,n=187)或单独化疗组(CTX;n=206)。最终研究队列包括来自SYNCHRONOUS试验的295例(75.1%)患者和来自CCRe-IV试验的98例(24.9%)患者。中位随访36.7个月(95%CI 36.6-37.3)。PTR组的中位OS为16.7个月(95%CI 13.2-19.2),CTX组为18.6个月(95%CI 16.2-22.3)。
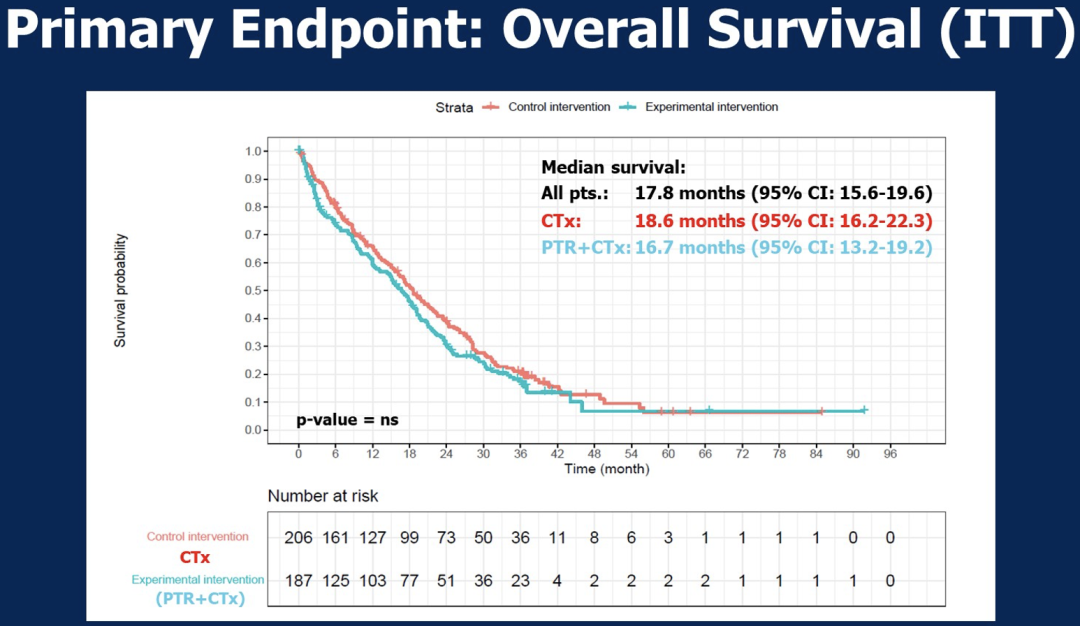
在最终分析中,基于比例风险模型(shaired frailty),OS没有显著性差异[风险比(HR)0.95,95%CI 0.743-1.215;p=0.685]。PTR组和CTX组分别有45例(24.1%)和13例(6.4%)患者未接受任何化疗。根据这些数据,严重不良事件(不包括术后并发症)在CTX组(44;20.7%)和PTR组(24;12.5%)没有差异。
本研究显示,在化疗前切除原发肿瘤并不会延长新诊断的IV期和伴有同时性不可切除转移灶的结肠癌患者的OS。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


