《自然·医学》:华人科学家推出研究 T 细胞抗肿瘤效率的模型
来源:奇点糕 2022-06-20 11:28
近十年以来,得益于肿瘤免疫基础研究的进步,继手术、放疗和化疗三大常规治疗手段之后,肿瘤免疫治疗已成为第四种肿瘤治疗方案。
近十年以来,得益于肿瘤免疫基础研究的进步,继手术、放疗和化疗三大常规治疗手段之后,肿瘤免疫治疗已成为第四种肿瘤治疗方案。
阻断CTLA-4和PD-1/PD-L1信号传导的免疫检查点抑制剂(ICI)[1],肿瘤浸润淋巴细胞(TIL)的过继转移[2],以及嵌合抗原受体T细胞(CAR-T)疗法[3]等肿瘤免疫治疗方案的出现,让常规治疗手段无效的肿瘤患者看到了延长生命,甚至是治愈的希望。
尽管肿瘤免疫疗法已成功应用于临床,但仍存在诸多影响治疗效果的因素[4]。比如,部分实体瘤组织中缺乏包括CD8+T细胞在内的免疫细胞浸润,呈现不利于免疫治疗的“冷肿瘤”微环境特征。肿瘤微环境也可能通过CTLA-4和PD-1/PD-L1信号传导以外的机制,例如替代检查点、免疫抑制细胞或细胞因子、肿瘤微环境中的代谢物等,抑制T细胞识别及杀伤肿瘤细胞。此外,独立于其它免疫抑制因子的细胞内在机制因素,也可能导致T细胞失去抗癌能力。
从肿瘤免疫基础研究的角度,无论是肿瘤的发生发展,还是肿瘤免疫治疗反应性差,核心问题都是体内抗癌T细胞的失能和耗竭。在复杂的免疫抑制肿瘤微环境中,甄别出具有高效抗癌能力的T细胞,对于开发新的肿瘤免疫治疗方案至关重要。
近日,由美国国家癌症研究所姜鹏领衔的研究团队在《自然•医学》发表重要研究结果[5]。
他们开发了一个计算模型:肿瘤韧性T细胞模型(Tres model)。这个模型可以通过分析T细胞单细胞转录组数据,鉴别在免疫抑制信号下仍然保持抗肿瘤能力的T细胞。
基于Tres模型,他们发现FIBP是Tres细胞的阴性标志基因。敲除CD8+T细胞的FIBP基因,可显著增强它的肿瘤细胞杀伤能力。这意味着,Tres模型鉴定的FIBP可作为预测免疫治疗效应的阴性标志物以及潜在的药物治疗新靶点。

文章首页
姜鹏团队这个研究中提及的肿瘤韧性T细胞(Tumor-resillient T cells, Tres)是一个比较新的概念。2020年,有研究人员在肿瘤免疫治疗的研究总结中,提出了韧性T细胞(resilient T cells, Trs细胞)这一概念[6]。
基于Trs细胞概念,姜鹏团队将Tres细胞定义为:一大类可以承受慢性肿瘤抗原刺激和肿瘤微环境抑制压力,而不会耗竭的T细胞。而且Tres细胞在ICI治疗后,能够迅速增殖并具有完全的细胞毒性功能。因此,Tres是具有高效抗癌能力的一大类CD8+T细胞。
目前已发现的Tres细胞包含干细胞样T细胞[7]和效应样T细胞[8]。在对ICI治疗有反应的人类和动物模型体内,均发现了效应样T细胞的存在[9-10]。在肿瘤免疫抑制微环境中,Tres细胞的韧性特征为:保有高度增殖活性和完全细胞毒性功能。
既然Tres细胞如此重要,那么该如何有效且可靠的识别Tres细胞呢?尽管肿瘤免疫治疗研究中累计了大量T细胞单细胞测序数据,遗憾的是,目前仍然没有基于分子特征的Tres细胞分析模型。
姜鹏团队开发的肿瘤韧性T细胞模型(Tres模型)就很好的解决了这个问题。
基于CytoSig数据平台,姜鹏团队首先筛选了免疫抑制信号分子。通过分析36个单细胞RNA测序数据集(跨越19种癌症类型168个肿瘤),该团队发现转化生长因子(TGF-β1)信号传导活性与T细胞增殖活性之间呈现一致的负相关性。类似地,肿瘤坏死因子相关诱导凋亡配体(TRAIL)和前列腺素E2(PGE2)信号活动与T细胞低增殖状态有显著相关性。进一步,通过对51个细胞因子的逐个分析,排除了其他免疫抑制因子与T细胞增殖的关联性,如IL-10,IL-4。
同时,细胞毒性评分(通过计算颗粒酶和穿孔素转录水平)与CytoSig分析的免疫抑制信号活性却不存在显著的负相关性。因此,在Tres模型中,姜鹏团队确定TGF-β1、TRAIL和PGE2,作为评估T细胞是否具有韧性特征(保有高度增殖能力)的3个免疫抑制信号分子。
接下来就是寻找Tres细胞的特征性基因。采用线性回归中的交互作用t检验,姜鹏团队分析了3个免疫抑制因子、T细胞增殖和特定的特征性基因之间的关系,而且他们还将交互变量t检验值定义为每个特征性基因的Tres评分。
在TGF-β1、TRAIL或PGE2信号通路的免疫抑制压力下,如一个基因的Tres评分为负数,表明高表达该基因的T细胞增殖能力非常弱。例如,在之前来自黑色素瘤的数据中,FIBP基因的Tres评分为-3.57。这个评分表明在TGF-β1、TRAIL或PGE2免疫抑制压力下,高表达FIBP基因的T细胞只具有低的增殖能力。据此,姜鹏团队完成了基于Tres评分的特征性基因的评估工作。
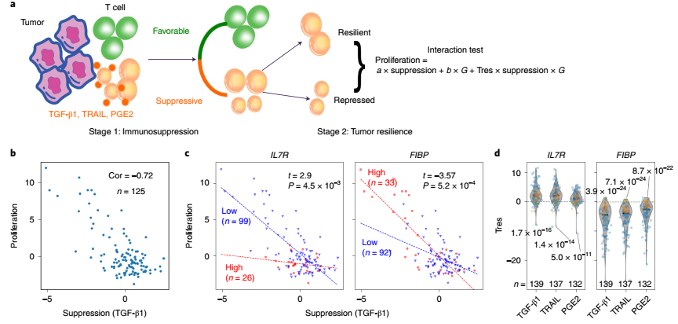
a: 建立Tres模型的分析流程模式图 b: 免疫抑制(TGF-β1)与T细胞增殖呈负相关 c: Tres 分数展示来自变量交互测试的结果 d: 队列中 Tres 评分
随后,姜鹏团队从生物和临床两方面验证了Tres模型的可靠性。
在生物学方面,Tres模型基于Tres评分预测的特征性基因,能够囊括已报道的干细胞样CD8+T细胞长期存活的标志基因。
在临床方面,无论是来自预处理肿瘤(未接受免疫治疗)或ICI应答者与无应答者的治疗后肿瘤数据,Tres模型预测的结果都能准确的匹配已知的临床治疗反应。此外,与其它已发表的抗肿瘤T细胞标志基因相比,Tres的总体关联性也是最好的。
以上数据表明,基于对3个免疫抑制因子(TGF-β1、TRAIL和PGE2)与T细胞增殖活性的关联性分析建立的Tres模型,是一种寻找抗癌T细胞的新方法。
同时,通过简单的相关系数分析,即如果肿瘤样本中T细胞单细胞转录组与Tres细胞特征呈负相关,那么就能够预测患者的临床免疫治疗效果不理想。这对于临床医生考量癌症患者是否适合接受肿瘤免疫治疗,具有十分重要的参考价值。
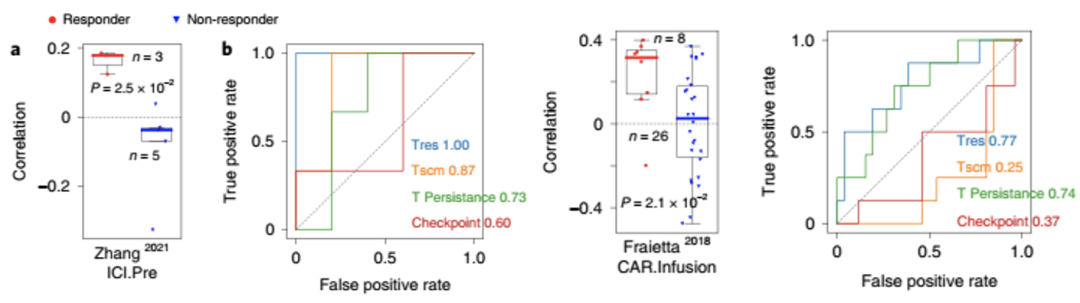
a: Tres 评分相关性预测T细胞在免疫疗法中的功效 b: Tres对T细胞临床疗效的预测性能
受到Tres模型出色预测T细胞抗癌能力的鼓舞,姜鹏团队着手从Tres细胞特征基因中筛选新的调节因子和治疗靶点。他们的筛选策略主要依据两个方面的考虑:一是优先考虑候选基因的表达水平始终与较差的T细胞抗肿瘤效应和实体瘤中较差的免疫治疗反应相关;二是分析侧重于T细胞有效性的阴性标记,因为无论是通过化合物、抗体还是基因组编辑的治疗方法,治疗机理主要是抑制靶基因。
基于以上考虑,姜鹏团队发现,在所有人类基因中,FIBP是排名第一位的T细胞抗癌有效性的阴性标志基因。并且,FIBP的Tres分数在所有单细胞数据集中始终为负。
姜鹏团队还分析了接受抗PD-1免疫治疗的实体瘤患者的T细胞单细胞测序数据。他们发现与无应答患者来源的T细胞相比,FIBP在抗PD-1治疗有效患者T细胞中的转录水平显著下降。同时,FIBP表达水平高的患者在过继性TIL治疗后,患者的总体生存时间更短。此外,高的FIBP表达水平与T细胞功能障碍呈现正相关性。基于以上证据,姜鹏团队认为FIBP是一个新的T细胞抗肿瘤效应的阴性标志物和潜在的药物治疗靶点。
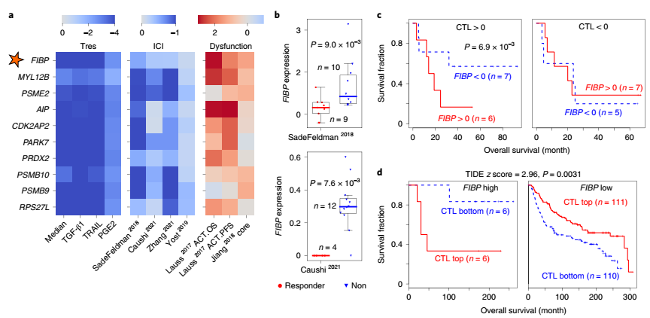
a: 按特征评分排名前十的基因热图 b: ICI应答者和无应答者CD8+ T细胞中的FIBP转录水平统计图 c: 肿瘤中扩增的淋巴细胞内FIBP的高表达预示低ACT功效 d: 肿瘤中高FIBP 转录水平预示T细胞功能障碍及更低的生存率
为了回答干预FIBP是否可以影响T细胞的抗肿瘤效应,姜鹏团队借助CRISPR/Cas9技术,分别在人和小鼠T细胞中敲除FIBP基因。在人的T细胞杀伤肿瘤细胞实验中,采用了NY-ESO-1+黑色素瘤细胞(A375和Mel624)作为NY-ESO-1 TCR T细胞的靶标细胞。
在小鼠T细胞杀伤肿瘤细胞实验,使用gp100阳性的B16-mhgp100细胞系和相应的Pmel-1 TCR T细胞。与对照组相比,敲除FIBP的人和小鼠T细胞释放更多的T细胞效应因子(如IFN-γ和TNF),杀伤肿瘤细胞的能力显著提高。
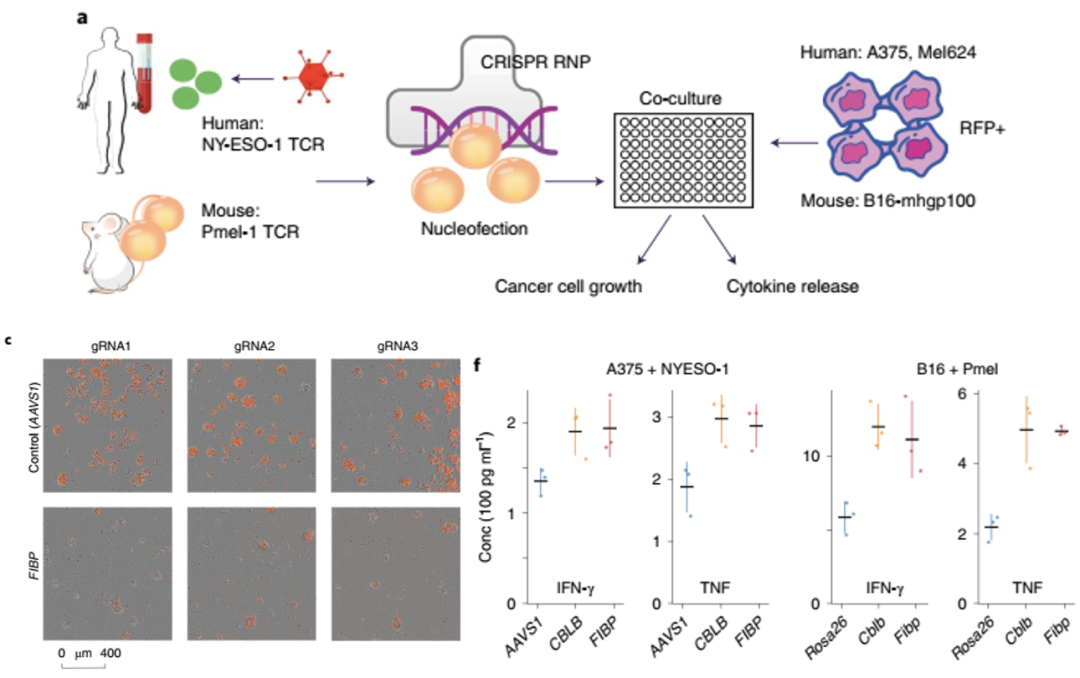
a: CD8+ T细胞与癌细胞共培养实验设计流程图 c: 细胞共培养杀伤实验的代表性数据 f: FIBP缺失促进T细胞效应细胞因子的释放
随后,姜鹏团队评估了敲除FIBP是否可以增强Pmel-1 T细胞的体内抗肿瘤功效。他们开展了小鼠体内肿瘤杀伤实验。与移植对照T细胞组相比,移植敲除FIBP基因T细胞的小鼠,体内肿瘤体积显著减小以及总体生存时间显著延长。
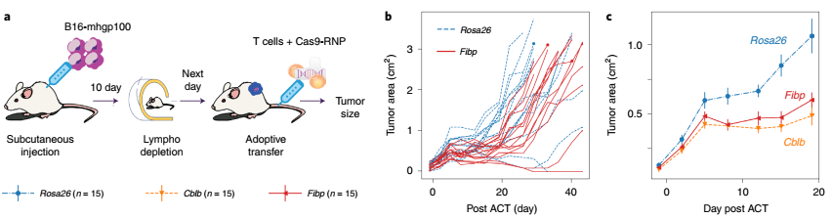
a: 过继性T细胞移植实验流程图 b: 小鼠体内肿瘤生长曲线 c: 小鼠体内肿瘤面积统计图
最后,为了深入了解FIBP对T细胞的抑制作用机制,姜鹏团队将小鼠敲除Fibp的Pmel-1 T细胞与对照组T细胞进行了转录组学测序分析。他们发现,敲除FIBP的T细胞排名靠前高富集的信号通路,都与下调的胆固醇代谢信号通路相关。
此前已有研究报道,肿瘤微环境中过高的胆固醇会抑制T细胞功能,促进T细胞耗竭[11]。因此,他们通过实验进一步证实,敲除FIBP的T细胞内胆固醇含量下降,胆固醇吸收也受到抑制,进而抵抗肿瘤微环境中过量胆固醇对CD8+T细胞功能的抑制作用。
总之,姜鹏团队基于大量已发表的T细胞单细胞转录组数据集,提出和建立了Tres模型,为预测癌症免疫治疗反应以及开发新的T细胞免疫疗法提供了一个崭新的平台。
虽然,Tres模型还有一些不足之处,比如之前分析的168个肿瘤样本中有38个没有达到统计学意义,以及在高度免疫抑制类型的肿瘤,Tres模型无法给出有意义的结果。但是,鉴于目前肿瘤免疫治疗存在费用高昂以及毒副作用的缺点,Tres模型有望通过预测癌症患者对于免疫治疗的反应,筛选出更适合接受免疫治疗的患者。
参考文献
1. Ribas A, Wolchok JD. Cancer immunotherapy using checkpoint blockade. Science. 2018 Mar 23; 359 (6382):1350-1355. doi: 10.1126/science.aar4060.
2. Rosenberg SA, Yang JC, Sherry RM, Kammula US, Hughes MS, Phan GQ, Citrin DE, Restifo NP, Robbins PF, Wunderlich JR, Morton KE, Laurencot CM, Steinberg SM, White DE, Dudley ME. Durable complete responses in heavily pretreated patients with metastatic melanoma using T-cell transfer immunotherapy. Clin Cancer Res. 2011 Jul 1;17(13):4550-7. doi: 10.1158/1078-0432.CCR-11-0116.
3. Robbins PF, Morgan RA, Feldman SA, Yang JC, Sherry RM, Dudley ME, Wunderlich JR, Nahvi AV, Helman LJ, Mackall CL, Kammula US, Hughes MS, Restifo NP, Raffeld M, Lee CC, Levy CL, Li YF, El-Gamil M, Schwarz SL, Laurencot C, Rosenberg SA. Tumor regression in patients with metastatic synovial cell sarcoma and melanoma using genetically engineered lymphocytes reactive with NY-ESO-1. J Clin Oncol. 2011 Mar 1; 29(7):917-24. doi: 10.1200/JCO.2010.32.2537.
4. Hegde PS, Chen DS. Top 10 Challenges in Cancer Immunotherapy. Immunity. 2020 Jan 14; 52(1):17-35. doi: 10.1016/j.immuni.2019.12.011.
5. Zhang Y, Trang V, Palmer DC, Kishton RJ, Gong L, Huang J, Nguyen T, Chen Z, Smith C, Livák F, Paul R, Day CP, Wu C, Merlino G, Aldape K, Guan XY, Jiang P. A T cell resilience model associated with response to immunotherapy in multiple tumor types. Nat Med. 2022 May 2. doi: 10.1038/s41591-022-01799-y.
6. Gicobi JK, Barham W, Dong H. Immune resilience in response to cancer therapy. Cancer Immunol Immunother. 2020 Nov; 69(11):2165-2167. doi: 10.1007/s00262-020-02731-4.
7. Yost KE, Satpathy AT, Wells DK, Qi Y, Wang C, Kageyama R, McNamara KL, Granja JM, Sarin KY, Brown RA, Gupta RK, Curtis C, Bucktrout SL, Davis MM, Chang ALS, Chang HY. Clonal replacement of tumor-specific T cells following PD-1 blockade. Nat Med. 2019 Aug; 25(8):1251-1259. doi: 10.1038/s41591-019-0522-3.
8. Fairfax BP, Taylor CA, Watson RA, Nassiri I, Danielli S, Fang H, Mahé EA, Cooper R, Woodcock V, Traill Z, Al-Mossawi MH, Knight JC, Klenerman P, Payne M, Middleton MR. Peripheral CD8+ T cell characteristics associated with durable responses to immune checkpoint blockade in patients with metastatic melanoma. Nat Med. 2020 Feb; 26(2):193-199. doi: 10.1038/s41591-019-0734-6.
9. Hudson WH, Gensheimer J, Hashimoto M, Wieland A, Valanparambil RM, Li P, Lin JX, Konieczny BT, Im SJ, Freeman GJ, Leonard WJ, Kissick HT, Ahmed R. Proliferating Transitory T Cells with an Effector-like Transcriptional Signature Emerge from PD-1+ Stem-like CD8+ T Cells during Chronic Infection. Immunity. 2019 Dec 17; 51(6):1043-1058.e4. doi: 10.1016/j.immuni.2019.11.002.
10. Yan Y, Cao S, Liu X, Harrington SM, Bindeman WE, Adjei AA, Jang JS, Jen J, Li Y, Chanana P, Mansfield AS, Park SS, Markovic SN, Dronca RS, Dong H. CX3CR1 identifies PD-1 therapy-responsive CD8+ T cells that withstand chemotherapy during cancer chemoimmunotherapy. JCI Insight. 2018 Apr 19;3(8):e97828. doi:10.1172/jci.insight. 97828.
11. Ma X, Bi E, Lu Y, Su P, Huang C, Liu L, Wang Q, Yang M, Kalady MF, Qian J, Zhang A, Gupte AA, Hamilton DJ, Zheng C, Yi Q. Cholesterol Induces CD8+ T Cell Exhaustion in the Tumor Microenvironment. Cell Metab. 2019 Jul 2; 30(1):143-156.e5. doi: 10.1016/j.cmet. 2019.04.002.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


