孕期缺铁,男宝会变女宝?最新Nature:铁缺乏会通过影响组蛋白修饰和基因表达,导致Sry基因表达下降,引发雄性向雌性的性别逆转
来源:生物谷原创 2025-06-10 10:30
这项研究以严谨的实验设计和深入的机制探讨,揭示了母体缺铁对胎儿性别发育的潜在风险。
“酸儿辣女”、“肚子形状看男女”......关于预测胎儿性别的民间说法流传甚广,虽然大多方法真假难辨,但也真实反映了人们对新生命性别的天然好奇。
在过去,我们普遍认为,胚胎的性别在受精的那一刻便由精子所携带的性染色体决定了:若精子携带 X 染色体,与卵子结合后胚胎性别为女性(XX);若携带 Y 染色体,则为男性(XY)。因此,从遗传学角度来看,宝宝的性别似乎 100% 由父亲决定。
然而,近日一项由日本大阪大学和澳大利亚昆士兰大学合作团队开展的研究,为我们揭示了影响胎儿性别决定的另一关键因素——母体的铁营养状况!研究发现,即使遗传上是雄性(XY)的小鼠胚胎,如果妈妈在孕期严重缺铁,其性腺也可能“逆转”发育成卵巢样结构,表达雌性标志基因!

研究意义以及背景
本研究旨在探究铁代谢、组蛋白去甲基化与性别决定之间的潜在关联,聚焦于孕期母体缺铁对胎儿性别发育的影响。
长期以来,科学界对性别决定机制的了解主要集中在基因层面,如 Sry 基因在雄性性别决定中的关键作用。然而,基因的表达并非孤立发生,其会受到多种表观遗传因素的调控,而「铁代谢」恰恰是其中至关重要的一环。
以往的研究表明,铁不仅是氧气运输的关键元素,在细胞内众多氧化还原反应中也发挥着不可替代的作用。特别是对于JmjC家族组蛋白去甲基化酶而言,亚铁离子(Fe2+)是其维持活性的核心辅因子。因此,本研究就聚焦于哺乳动物性别决定过程中的关键基因Sry,深入探索了铁代谢是如何通过影响组蛋白去甲基化,进而作用于 Sry 基因的表达,最终影响胎儿性别发育。
小鼠实验设计
研究人员以小鼠为实验对象,精心设计了多种实验方案以模拟母体缺铁环境,进而观察其对胎儿性别发育的影响。
首先,研究团队利用铁螯合剂去铁胺(DFO)处理怀孕小鼠,从而在胚胎性别决定的关键时期(E6.5 至 E10.5)诱导母体缺铁状态,以此来研究急性缺铁对胎儿性别发育的影响。
与此同时,为了进一步验证长期饮食缺铁的影响,研究人员还让部分怀孕小鼠在孕前 4 周以及整个孕期食用低铁饮食,直至分娩。
此外,研究者借助基因编辑技术构建了特异性敲除Tfrc基因(编码转铁蛋白受体1,是细胞摄取铁的关键基因)的小鼠模型,用以探索铁摄取障碍对胎儿性别发育的作用。
铁摄取与性别决定的神秘联系
在对小鼠胚胎性腺发育过程的深入观察中,研究人员发现了一个有趣的现象:与铁摄取以及 Fe²⁺产生相关的基因表达量明显上升,而这些基因的活跃表达主要集中在决定性别的关键细胞——前Sertoli细胞中。
无独有偶,在人类XY性腺发育的过程中,也发现了类似的规律。KDM3A以及那些和铁摄取、Fe²⁺产生相关的基因,在男性性别决定关联细胞中的表达量,相比其他类型的细胞更高。借助免疫组织化学和荧光染色实验,研究人员在小鼠胚胎发育到E11.5时期时看到,性腺中和铁摄取相关的蛋白TFR1、Scara5,以及和Fe²⁺产生相关的蛋白Ncoa4、HO1的表达水平都处于高位。
这些迹象都指向一个结论:在性别决定的关键时期,性腺细胞需要大量的Fe²⁺来支持组蛋白去甲基化和Sry基因的表达。
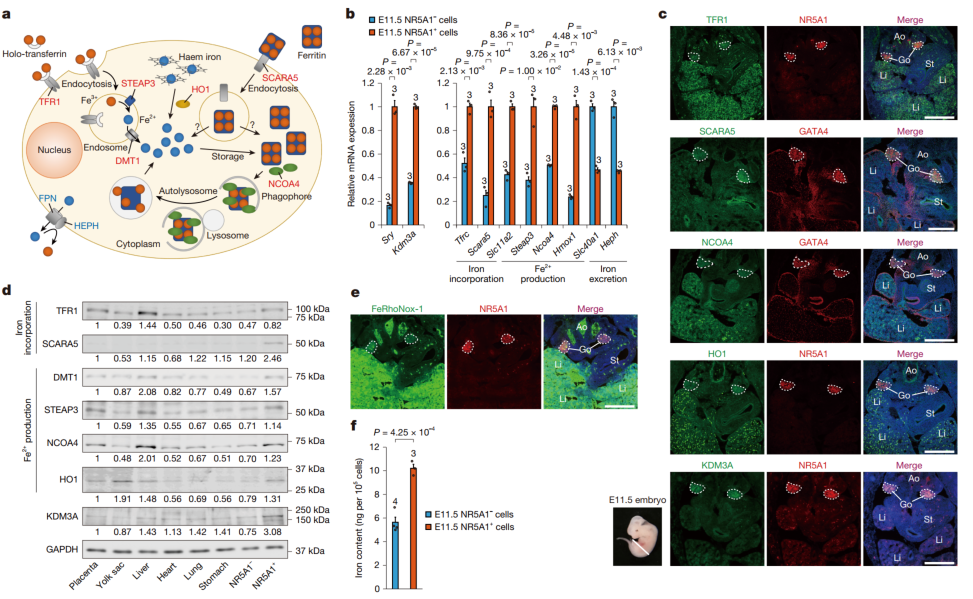
图1:铁代谢途径在胚胎性腺中的激活
缺铁对胎儿性别有何影响?
到这里,研究人员已经明确了铁元素在胎儿性别决定过程中的关键地位。那缺铁对胎儿性别会有什么影响呢?
针对这个问题,研究人员先是开展了体外培养小鼠性腺的实验,并且利用铁螯合剂(像DFO这类物质)来降低铁水平。结果发现了很严重的情况:铁的缺乏会导致性腺中H3K9me2水平显著上升,同时Sry基因的表达被几乎完全抑制,进而使得性腺朝着卵巢的方向发育。
具体点来说,在经过DFO处理的XY性腺里,本该出现的睾丸标志物SOX9几乎没了踪影,反而是卵巢标志物FOXL2+表达的细胞大量涌现,占比飙到了90%。不过XX性腺在DFO处理后,并没有受到波及,依旧正常地分化成女性型性腺。
更有说服力的是,后续实验表明,只要强制表达Sry基因,DFO处理过的XY性腺就能恢复男性型性腺的分化路径。这就清楚地表明,铁缺乏导致的Sry基因表达缺失,正是造成性别逆转的罪魁祸首。
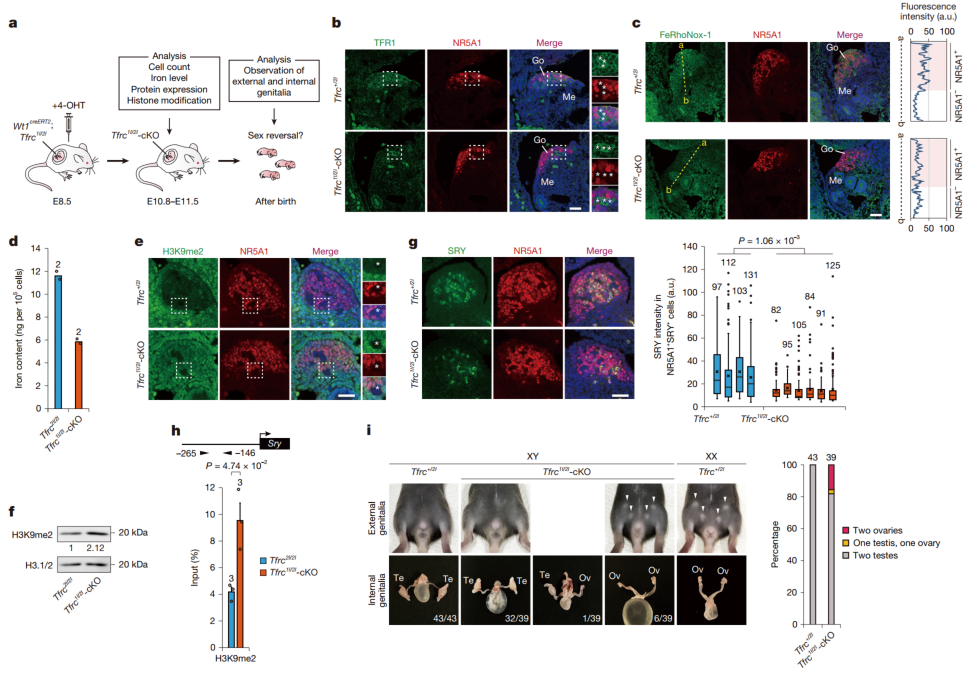
图2:TFR1介导的铁摄取会增强Sry基因的H3K9去甲基化
铁缺乏影响胎儿性别的分子机制
接着,在分子层面,研究人员详细阐释了铁缺乏对Sry基因表达和组蛋白修饰的影响。
他们发现,经DFO处理后,与Sry基因表达相关的早期性腺发育基因表达并未受到影响,但Sry基因本身的表达却显著降低。进一步研究发现,其背后的机制是DFO处理使Sry启动子区域的H3K9me2水平近乎翻倍。这表明,铁缺乏时,KDM3A介导的H3K9去甲基化过程受阻,从而影响了Sry基因的正常表达。
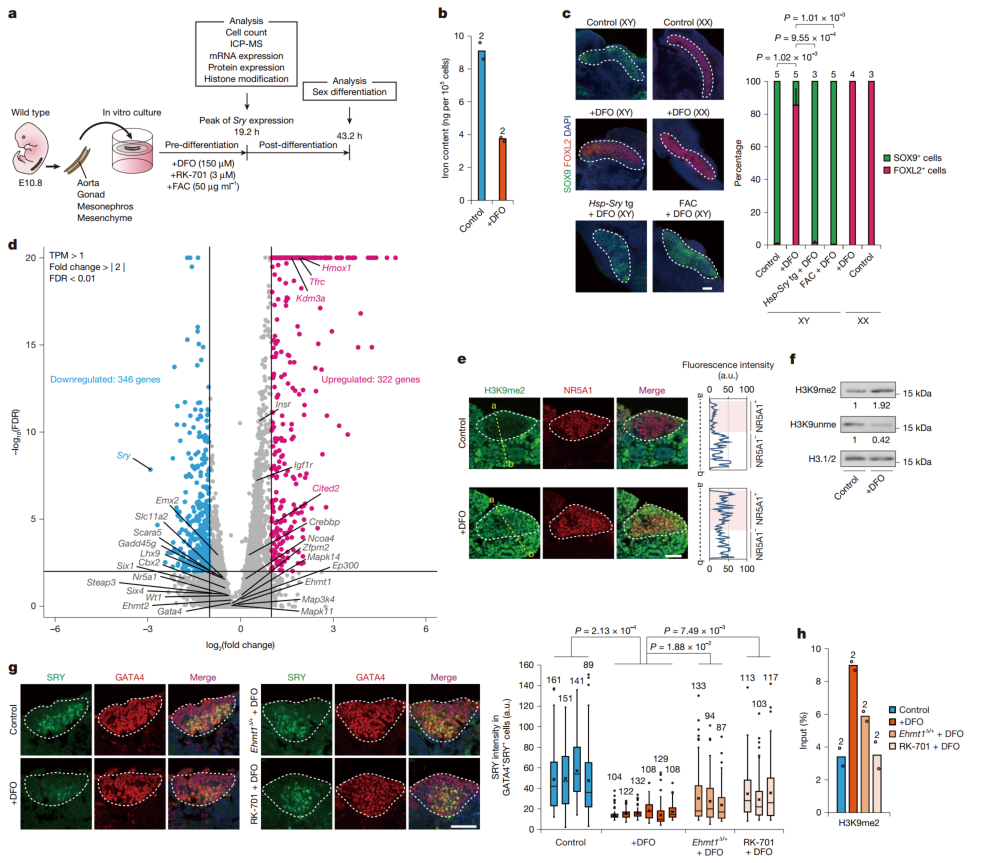
图3:铁缺乏导致培养性腺中Sry激活受阻
为了进一步证实铁代谢在性别决定中的关键作用,研究人员对Tfrc基因(Tfrc基因编码转铁蛋白受体,主要功能是介导细胞对铁的摄取)进行了条件性敲除。研究发现,与对照组相比,Tfrc1l/2l 敲除后,胚胎性腺细胞内的Fe²⁺水平显著降低,H3K9me2水平翻倍,Sry mRNA表达量减少约一半,SRY蛋白表达也降低了约 50%。
具体而言,到了胚胎发育第 13.5 天(E13.5),部分XY Tfrc1l/2l 敲除胚胎的性腺出现发育异常,表现为卵睾性腺,即卵巢和睾丸组织混合。成年后检查发现,在 39 只 XY Tfrc1l/2l 敲除小鼠中,有 6 只完全出现雄性向雌性性别逆转,表现为双侧卵巢,另有 1 只部分雌性化,一侧为卵巢,另一侧为睾丸。
而在胚胎性别决定阶段(E6.5 至 E10.5),当研究人员给怀孕母鼠口服铁螯合剂DFX后,约7%的XY后代发生了雄性到雌性的性别逆转——在72只XY小鼠中,有4只发育出双侧卵巢,1只发育了一个卵巢和一个睾丸。
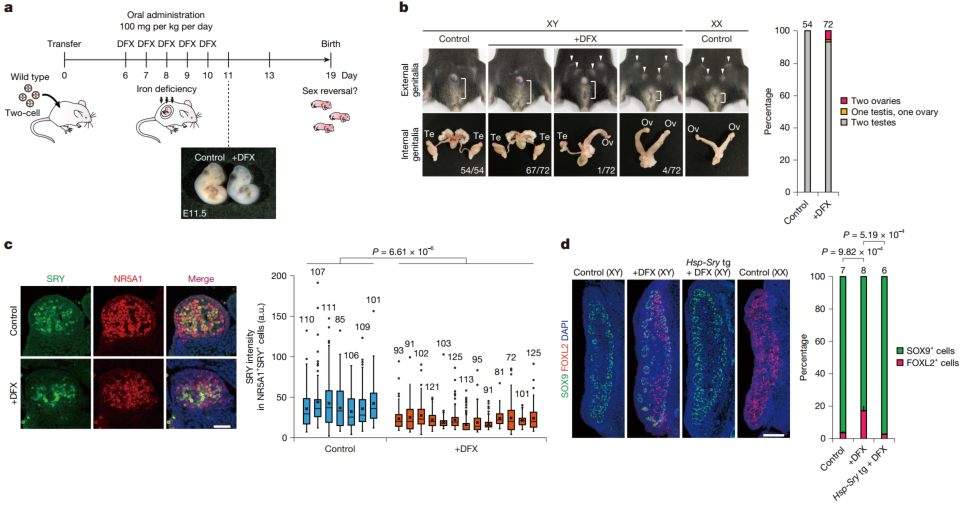
图4:药物诱导的母体铁缺乏导致胚胎性别逆转
最后,在母体低铁饮食实验中,研究人员让母鼠在孕前 4 周及整个孕期食用低铁饮食。实验结果表明,单独的低铁饮食对性别决定并无显著影响。但当母鼠携带Kdm3a基因杂合突变时,低铁饮食导致约5%的XY后代发生性别逆转。在43只XY小鼠中,有2只发育出双侧卵巢。
单细胞 RNA 测序结果显示,在E11.5小鼠性腺中,与铁摄取和Fe²⁺产生的基因在前Sertoli 细胞中的表达更为丰富,而铁储存基因则相反。
类似趋势也在人类 XY 发育性腺中得到观察:KDM3A和铁摄取、Fe²⁺产生基因在男性性别决定相关细胞中的表达高于其他细胞类型。
此外,免疫组织化学与荧光染色实验表明,在E11.5小鼠性腺中,铁摄取相关蛋白TFR1和Scara5以及Fe²⁺产生相关蛋白Ncoa4和HO1的表达水平较高。荧光探针检测显示,E11.5性腺中 Fe²⁺的荧光信号强度较高,表明性腺细胞中Fe²⁺积累较多。ICP-MS 分析结果也进一步证实了这一点——NR5A1+细胞中的总铁含量比NR5A1− 细胞高1.8倍。
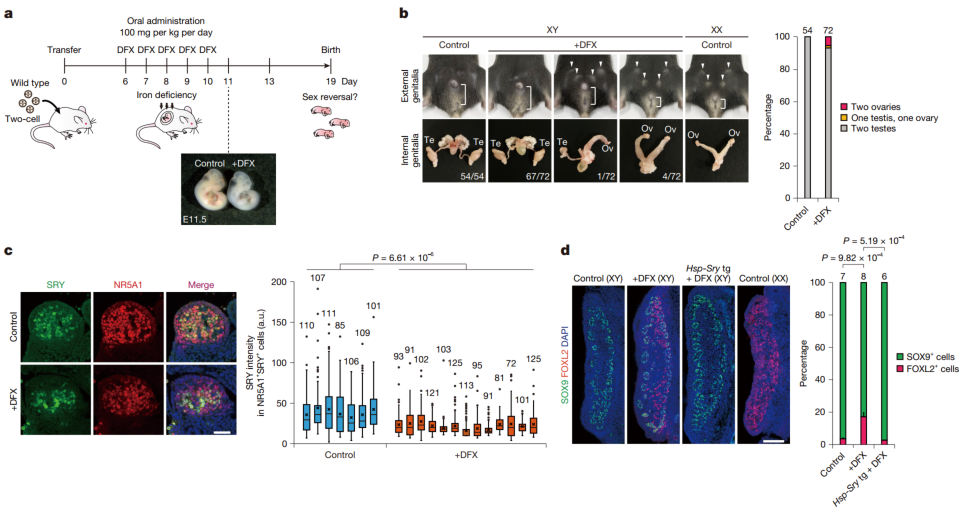
图5:母体饮食铁缺乏对胎儿性腺发育和性别的影响
小结
综上所述,这项研究以严谨的实验设计和深入的机制探讨,揭示了母体缺铁对胎儿性别发育的潜在风险。
在全球范围内,大约35.5%的孕妇存在缺铁状况。许多女性在怀孕前并没有缺铁的问题,但在怀孕后,由于胎儿对铁元素的需求增加,母体的铁储备常常被大量消耗,导致疲劳、免疫力下降等问题。而这项研究则进一步指出,在胎儿发育过程中,特别是在性别决定的关键时期,母体的铁水平对胎儿的性别发育具有重要影响。
因此,无论是生男还是生女,孕妈妈的铁补充都至关重要。不过,补铁也需要科学合理,请不要自己瞎补充,先去医院咨询一下医生哦!
参考文献:
Okashita N, Maeda R, Kuroki S, et al. Maternal iron deficiency causes male-to-female sex reversal in mouse embryos. Nature. Published online June 4, 2025. doi:10.1038/s41586-025-09063-2
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


