《科学·转化医学》:癌细胞“断糖”,免疫治疗更强!
来源:奇点糕 2022-12-02 13:34
肿瘤微环境中大量存在的唾液酸聚糖可与TAMs表面的Siglec-E结合,促进其发生M2极化,靶向唾液酸聚糖-Siglec轴就可以解除这种免疫抑制性微环境,促使TAMs发生M1极化,增强CD8+T细胞功
在当前的肿瘤免疫治疗中,纳武利尤单抗、帕博利珠单抗等免疫检查点抑制剂取得了不错的治疗效果,然而治疗耐药使多数患者不能实现长期生存[1]。免疫治疗通过激活机体免疫系统对抗肿瘤的同时,肿瘤自身也会通过功能及代谢重编程导致治疗抵抗的发生[2]。
免疫检查点抑制剂主要依靠肿瘤细胞自身PD-L1的表达,及具有肿瘤识别和杀伤作用的CD8+T细胞的浸润发挥抗肿瘤作用,肿瘤内CD8+T细胞的浸润程度与免疫检查点抑制剂的治疗缓解率呈正相关[3]。
如何提高肿瘤微环境中CD8+T细胞的浸润程度,解除免疫抑制性肿瘤微环境,使“冷肿瘤”变为“热肿瘤”以增强抗肿瘤免疫,是当前研究的重要方向。
近日,由瑞士巴塞尔大学附属医院生物医学中心的Heinz Läubli教授及Michal A. Stanczak教授带领的研究团队在Science Translational Medicine期刊发表重要研究成果[4]。

该研究发现,唾液酸聚糖在肿瘤微环境中丰度较高,靶向肿瘤微环境中的唾液酸聚糖及其配体可促进TAMs发生M1极化,增强CD8+T细胞功能,并可增强PD-1抑制剂与CTLA-4抑制剂的联合治疗效果,因此降低肿瘤微环境中的唾液酸聚糖水平是一种重塑巨噬细胞表型、增强适应性抗肿瘤免疫反应的有效方法。
肿瘤微环境中唾液酸聚糖分子丰度较高,呈高唾液酸化水平,其可与肿瘤浸润免疫细胞上的唾液酸结合性免疫球蛋白样凝集素(Siglec)结合,从而形成免疫抑制性的肿瘤微环境,损伤抗肿瘤免疫[5]。
免疫系统中Siglec家族含有多种Siglec分子,均呈现不同的表达谱。研究发现肿瘤相关巨噬细胞(TAMs)表达CD33相关的抑制性Siglec分子,人源性的Siglec-7、Siglec-9及鼠源性的Siglec-E均可促进M2极化进而导致肿瘤进展;此外,Siglec-7、Siglec-9还可抑制NK细胞及肿瘤浸润性T细胞的肿瘤杀伤作用[6]。
研究表明,靶向唾液酸聚糖-Siglec轴可活化固有免疫及适应性免疫[6]。然而,靶向该调控轴的具体机制仍不明确,具体的干预手段亦需要进一步探索。
首先,研究人员通过TCGA数据库及临床样本发现,肿瘤微环境中较高的唾液酸聚糖水平往往伴随着较短的生存时间,同时还与免疫抑制性肿瘤微环境的形成,以及T细胞功能失调相关。为了进一步验证上述结果,研究人员通过基因编辑,对结肠癌细胞系MC-38中唾液酸聚糖合成限速酶GNE进行了基因敲除。
通过GNE敲除的MC-38细胞系的CDX模型,研究人员发现,低唾液酸水平可显著抑制肿瘤生长,甚至可使肿瘤消退;同时,低唾液酸水平还可使CD8+T细胞中IFN-γ及TNF的表达量上升。联合免疫检查点抑制剂干预后,GNE敲除对肿瘤生长的抑制作用,以及对CD8+T细胞功能的促进可进一步增强。
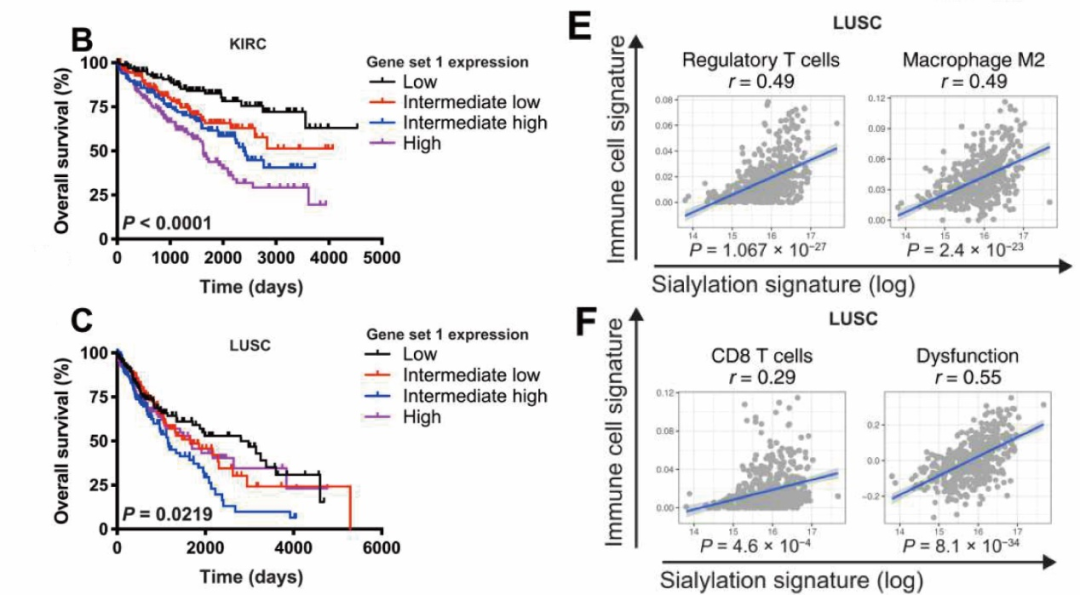
肿瘤微环境中唾液酸聚糖的表达水平与生存及关键免疫细胞的相关性
接下来研究人员成功构建了唾液酸酶-曲妥珠单抗融合蛋白E-301,以实现对HER2阳性肿瘤微环境中唾液酸聚糖的降解。为了检测E-301的治疗效果,研究人员构建了HER2阳性的EMT6乳腺癌细胞系及B16D5黑色素瘤细胞系的CDX模型。研究人员发现,E-301干预可显著抑制CDX肿瘤的生长,显著延长CDX小鼠的生存时间,并未导致毒性反应的发生。
与此同时,CD8+T细胞的去除可抵消E-301对肿瘤生长的抑制作用,这就表明E-301可通过激活适应性免疫抑制肿瘤的生长。此外,研究人员还发现E-301的唾液酸聚糖降解作用发生在包括TAMs在内的几乎所有的免疫细胞中,主要降解N端唾液酸化的聚糖分子。
为了进一步明确肿瘤微环境中唾液酸聚糖降解对肿瘤浸润性免疫细胞的影响,研究人员对CDX肿瘤组织中的肿瘤浸润性免疫细胞进行了单细胞RNA测序分析。分析结果表明,E-301联合免疫检查点抑制剂干预后,TAMs中M1的比例增加,而M2的比例呈下降趋势。
研究人员又对CDX肿瘤组织进行了流式细胞术分析,发现E-301干预后表达CD80的M1型TAMs比例升高,而表达CD206的M2型TAMs比例减少;此外,E-301干预还可导致CD8+T细胞的激活标志物CD25与功能标志物颗粒酶B的表达水平的升高。通过体外的肿瘤细胞与巨噬细胞的共培养模型,研究人员也证实肿瘤微环境中唾液酸聚糖的降解可促进TAMs发生M1极化、增强CD8+T细胞的功能。
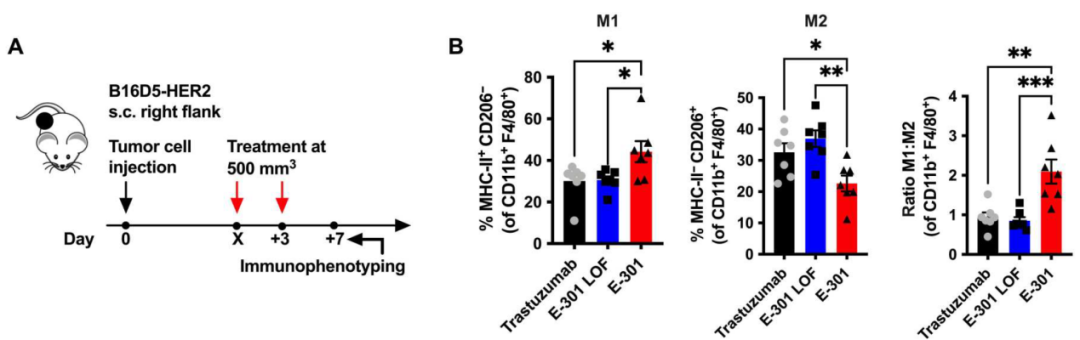
E-301、E-301失活体及曲妥珠单抗干预下TAMs中M1、M2及M1/M2比率的改变情况
为了探究唾液酸聚糖的降解是如何导致TAMs发生M1极化的,研究人员将注意力转移到了TAMs表面的唾液酸聚糖受体Siglec分子上。
结合之前的单细胞测序数据,研究人员发现在Siglec家族中,Siglec-E在TAMs中的表达占主导地位;CDX小鼠TAMs表面Siglec-E的缺失可抑制肿瘤的生长,并促进M1型TAMs数目的增加及CD8+T细胞中CD25的表达,同时还可削弱E-301对肿瘤的抑制作用以及对M1及CD8+T细胞的促进作用。
这些现象说明,肿瘤微环境中的唾液酸聚糖是依赖于TAMs表面的Siglec-E发挥作用的。最后,研究人员证实肿瘤细胞中唾液酸聚糖合成限速酶GNE的敲除,可降解肿瘤微环境中唾液酸聚糖的E-301的干预以及TAMs表面唾液酸聚糖配体Siglec-E的敲除,均可增强PD-1抑制剂与CTLA-4抑制剂的联合治疗疗效。
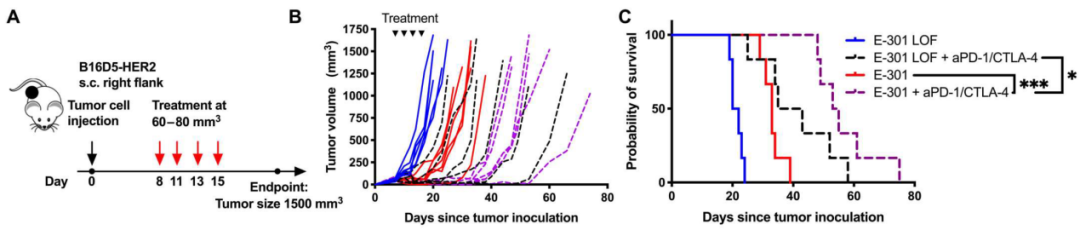
E-301或E-301失活体联合PD-1单抗或CTLA-4单抗干预后B16D5-HER2小鼠的生存情况
总的来说,肿瘤微环境中大量存在的唾液酸聚糖可与TAMs表面的Siglec-E结合,促进其发生M2极化,靶向唾液酸聚糖-Siglec轴就可以解除这种免疫抑制性微环境,促使TAMs发生M1极化,增强CD8+T细胞功能,并增敏免疫检查点抑制剂。同时,体内试验的结果也证实肿瘤微环境中唾液酸聚糖的降解可进一步增强PD-1抑制剂与CTLA-4抑制剂的联合治疗效果。
这项研究为肿瘤微环境中高唾液酸水平介导的免疫抑制提供了机制证据,证明了唾液酸聚糖降解作为潜在肿瘤治疗方法的有效性和可行性,并强调了其与经典免疫检查点抑制剂联合使用的潜力。
参考文献:
1.Topalian SL, Drake CG, Pardoll DM. Immune checkpoint blockade: a common denominator approach to cancer therapy. Cancer Cell. 2015;27(4):450-461. doi:10.1016/j.ccell.2015.03.001.
2.Christofides A, Strauss L, Yeo A, Cao C, Charest A, Boussiotis VA. The complex role of tumor-infiltrating macrophages. Nat Immunol. 2022;23(8):1148-1156. doi:10.1038/s41590-022-01267-2.
3.Liu YT, Sun ZJ. Turning cold tumors into hot tumors by improving T-cell infiltration. Theranostics. 2021;11(11):5365-5386. Published 2021 Mar 11. doi:10.7150/thno.58390.
4.Stanczak MA, Rodrigues Mantuano N, Kirchhammer N, et al. Targeting cancer glycosylation repolarizes tumor-associated macrophages allowing effective immune checkpoint blockade. Sci Transl Med. 2022;14(669):eabj1270. doi:10.1126/scitranslmed.abj1270.
5.Fraschilla I, Pillai S. Viewing Siglecs through the lens of tumor immunology. Immunol Rev. 2017;276(1):178-191. doi:10.1111/imr.12526.
6.Läubli H, Nalle SC, Maslyar D. Targeting the Siglec-Sialic Acid Immune Axis in Cancer: Current and Future Approaches [published online ahead of print, 2022 Oct 20]. Cancer Immunol Res. 2022. doi:10.1158/2326-6066.CIR-22-0366.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


