《神经元》:阿尔茨海默病重大突破!上海有机所团队发现APOE蛋白隐秘功能,破解APOE与AD关系差异巨大之迷
来源:奇点糕 2023-04-26 08:05
陈椰林团队的这项研究成果从另一个角度阐释了APOE2和APOE4功能上的差异,让我们对APOE与阿尔茨海默病之间的关系有了新的认知。 值得一提的是,这个研究也是首次将家族性阿尔茨海默病的风险基因
众所周知,载脂蛋白E(APOE)是阿尔茨海默病最大的遗传风险因素。
APOE有三个亚型,分别是APOE2、APOE3和APOE4。这三个亚型仅在第112、158位两个氨基酸位置上存在不同,但是与阿尔茨海默病的关系却有天壤之别[1,2]。
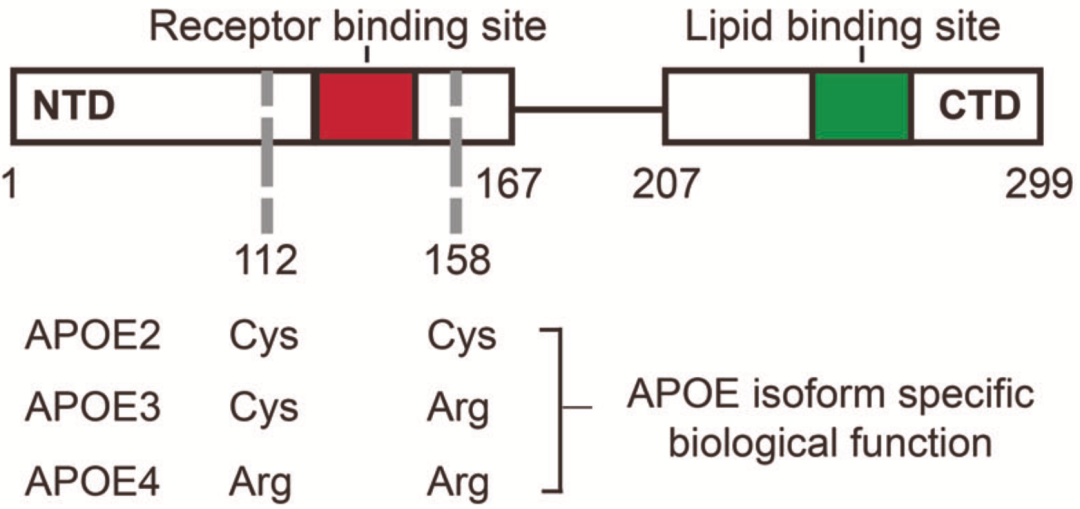
三个APOE亚型的差异
与纯合APOE3相比,杂合APOE2/3与患阿尔茨海默病风险降低61%相关,纯合APOE2与患阿尔茨海默病风险降低87%相关[1];杂合APOE2/4与患阿尔茨海默病风险升高1.64倍相关,杂合APOE3/4与患阿尔茨海默病风险升高2.63倍相关,而纯合APOE4则与患阿尔茨海默病风险升高近14倍相关[2],简直高到离谱!
不难看出,与常见的APOE3相比,仅一个氨基酸之差的APOE2可以预防阿尔茨海默病,同样仅一个氨基酸之差的APOE4则是强烈的阿尔茨海默病驱动因素。
你肯定和我一样想知道这究竟是为什么。
前不久,西湖大学施一公团队在小胶质细胞表面找到了APOE4的特异性受体LilrB3,APOE4与LilrB3特异性结合后,可激活小胶质细胞,使其转为促炎状态;有意思的是,LilrB3几乎不与APOE2结合[3]。
就在我以为这是APOE三兄弟存在巨大差异的全部原因的时候,中国科学院上海有机化学研究所陈椰林/耿泱团队,在《细胞》著名子刊《神经元》杂志发表重磅研究成果告诉我:真相远不止如此。
他们首次发现,APOE可以通过其保守的C-末端区域(CT),以底物特异性的方式抑制γ-分泌酶(剪切淀粉样前体蛋白[APP],产生Aβ的关键酶)的活性[4]。
有趣的是,APOE三兄弟对γ-分泌酶的抑制活性存在差异,表现为APOE2>APOE3>APOE4,而这刚好跟它们与阿尔茨海默病风险关系相反。因此,这个研究在一定程度上也能解释APOE不同亚型与阿尔茨海默病之间的关系。中国科学院上海有机化学研究所侯祥龙和张雪馨为论文的共同第一作者。

论文首页截图
为了研究APOE三兄弟与阿尔茨海默病风险关系的差异,陈椰林团队先对人脑样本进行了免疫荧光染色,以确认APOE存在的位置。
染色结果与之前的研究保持了一致,在神经元和胶质细胞中都检测到了APOE。重要的是,免疫染色显示,内源性APOE和APP在人类皮质神经元中共存,而且二者的荧光信号存在重叠。
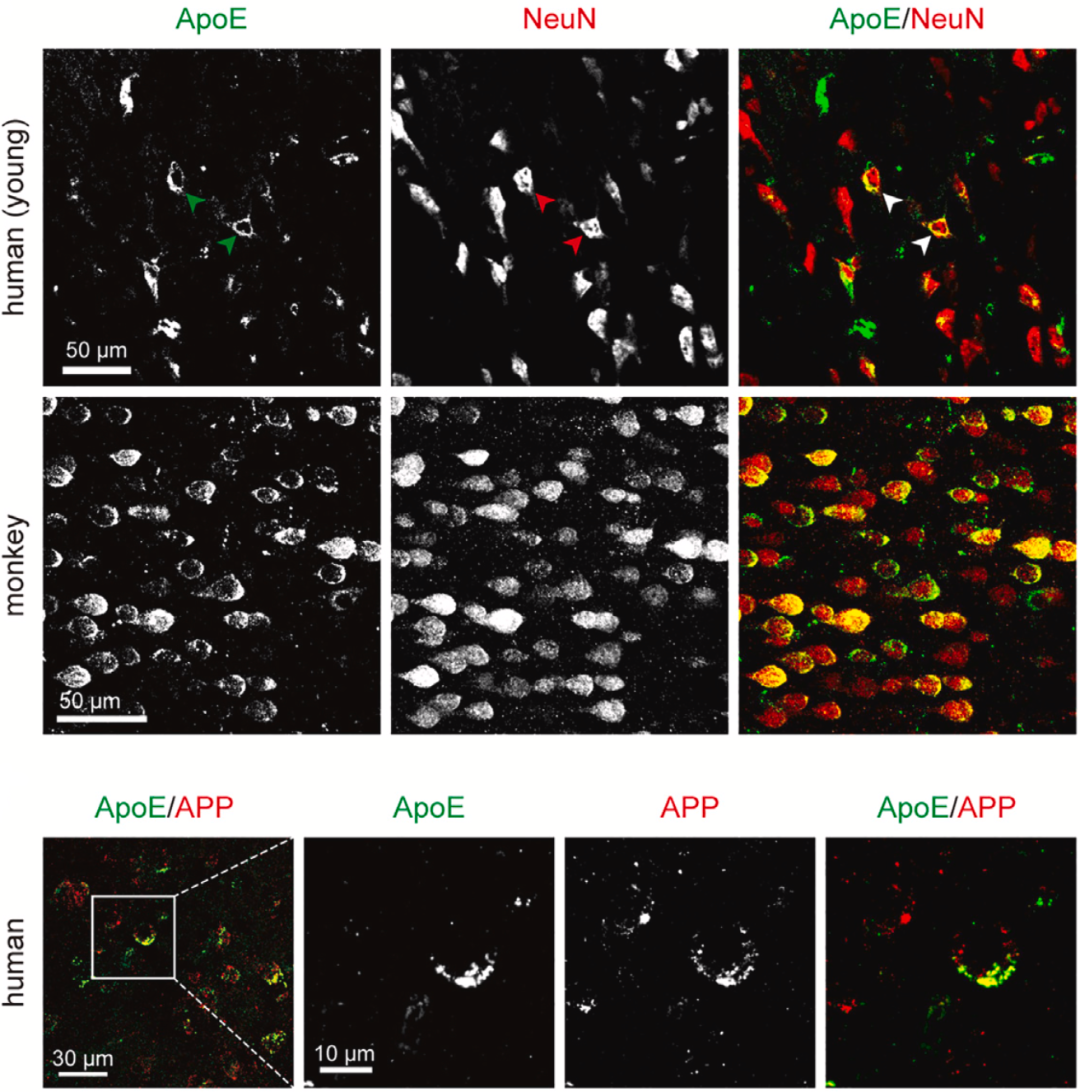
神经元中存在APOE,而且APOE与APP共定位
APOE与APP共定位让陈椰林团队意识到,APOE对神经元自主剪切APP可能有一定的影响。
为了证实这一猜想,他们在神经元细胞系(N2A)和HEK 293T细胞中共表达APP和APOE,并将APP的非淀粉样蛋白源性裂解产物α-C末端片段(α-CTF)作为标志物。如果共表达细胞产生的α-CTF较多,就意味着“毒蛋白”β淀粉样蛋白(Aβ)的产生会减少。
从实验结果来看,在N2A和HEK 293T细胞中,与GFP与APP共表达相比,APOE2或APOE3与APP的共同表达明显增加了α-CTF的水平。值得注意的是,APOE2与APP的共同表达显著减少了总Aβ40的产生。不过,与对照组相比,APOE4和APP的共同表达未能改变α-CTF和Aβ40。
不难看出,APOE确实在调节APP的剪切,而且APOE2确实抑制了Aβ40的产生。
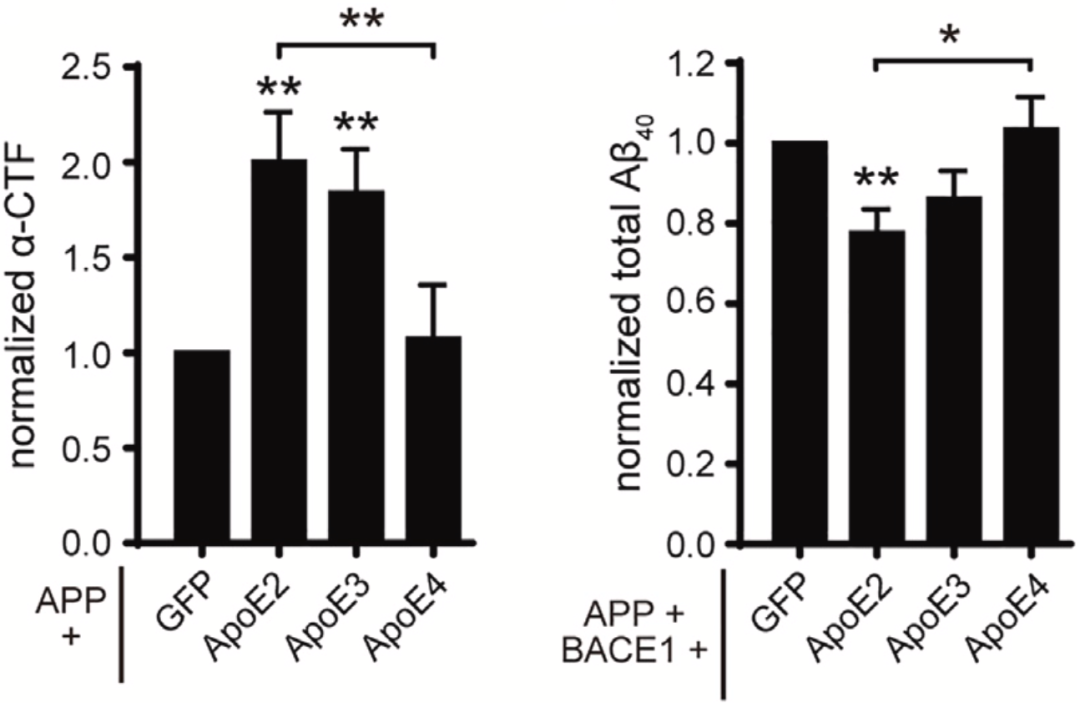
APOE对APP剪切的影响
问题又来了,究竟是APOE的那个部分在调控APP的剪切呢?
陈椰林团队先从APOE2入手,发现起关键作用的是APOE的C-末端区域(CT),而不是存在差异的N-末端区域(NT)。从实验结果来看,共表达APOE-CT和APP后,细胞培养基中的Aβ40减少了约75%,细胞裂解液中Aβ40减少了约42%,Aβ42减少了约74%,但Aβ42/Aβ40的比例没有变化。
值得注意的是,与APOE2相比,APOE-CT进一步增加了α-CTF水平,表明APOE-CT比全长APOE2更具活性,而且APOE的NT区可能在某种程度上阻碍了这种活性。此外,他们还注意到,只有细胞内的APOE有这一作用,在培养基中添加APOE则没有这个效果。这也说明,是细胞内源性APOE在调节APP的剪切。
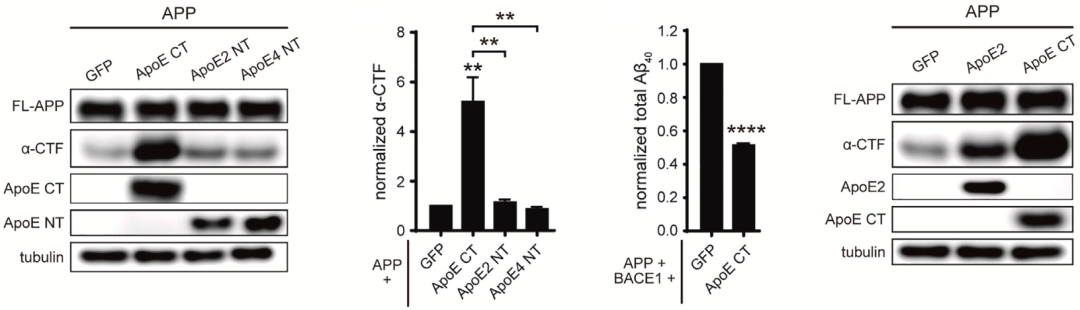
APOE-CT的超能力
那APOE蛋白在细胞内又是如何调节APP剪切的呢?
经过一系列复杂的实验,陈椰林团队发现APOE2和APOE-CT能与APP、γ-分泌酶和α-分泌酶相互作用,而不与BACE1相互作用。
从机制上看,APOE-CT能抑制γ-分泌酶的剪切作用,而不直接调节α或β-剪切作用。此外,γ-分泌酶是APOE-CT增加α-CTF水平所必需的,且APOE-CT对γ-分泌酶的抑制作用是具有底物特异性的,不影响γ-分泌酶对其他蛋白的γ-剪切。
结合前面的研究成果,我们可以发现,APOE2保留了较强的γ-分泌酶抑制活性,而APOE4可能完全丢失这一活性。遗憾的是,这个研究并没有告诉我们:为何两两之间相差一两个氨基酸的APOE两兄弟,在抑制γ-分泌酶活性方面存在这么大的差异。
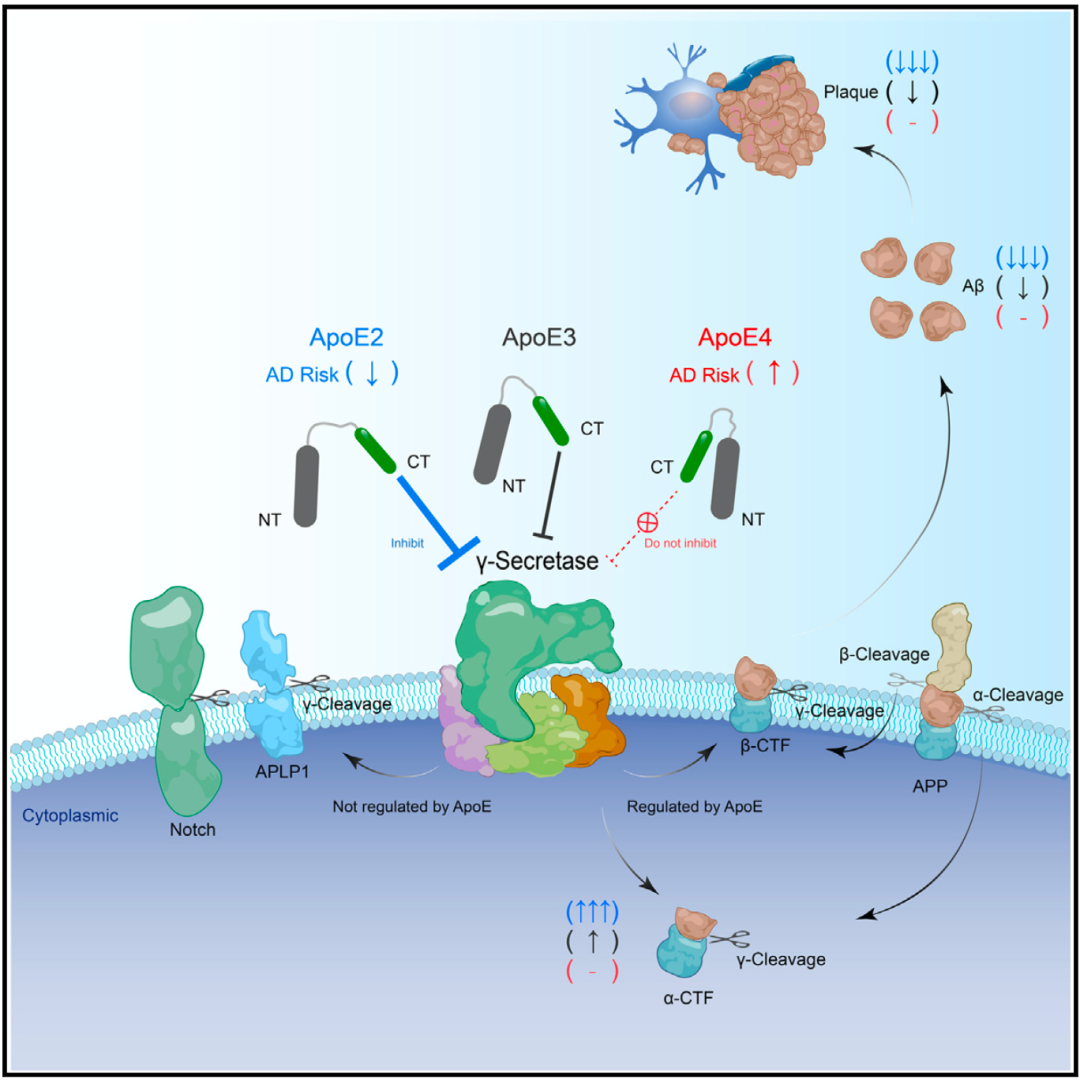
潜在机制示意图
总的来说,陈椰林团队的这项研究成果从另一个角度阐释了APOE2和APOE4功能上的差异,让我们对APOE与阿尔茨海默病之间的关系有了新的认知。
值得一提的是,这个研究也是首次将家族性阿尔茨海默病的风险基因(编码γ-分泌酶)与散发性阿尔茨海默病联系在一起,提示APP的γ酶切异常是所有阿尔茨海默病的共同致病原因。
参考文献:
[1].Reiman EM, Arboleda-Velasquez JF, Quiroz YT, et al. Exceptionally low likelihood of Alzheimer's dementia in APOE2 homozygotes from a 5,000-person neuropathological study. Nat Commun. 2020;11(1):667. Published 2020 Feb 3. doi:10.1038/s41467-019-14279-8
[2].Yamazaki Y, Zhao N, Caulfield TR, Liu CC, Bu G. Apolipoprotein E and Alzheimer disease: pathobiology and targeting strategies. Nat Rev Neurol. 2019 Sep;15(9):501-518. doi: 10.1038/s41582-019-0228-7. Epub 2019 Jul 31. PMID: 31367008; PMCID: PMC7055192.
[3].Zhou J, Wang Y, Huang G, et al. LilrB3 is a putative cell surface receptor of APOE4. Cell Res. 2023;33(2):116-130. doi:10.1038/s41422-022-00759-y
[4].Hou X, Zhang X, Zou H, et al. Differential and substrate-specific inhibition of γ-secretase by the C-terminal region of ApoE2, ApoE3, and ApoE4. Neuron. 2023;S0896-6273(23)00220-9. doi:10.1016/j.neuron.2023.03.024
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


