Cell:核糖体“撞车”引发的基因命运!m⁶A调控mRNA降解的意外发现!
来源:生物探索 2025-05-08 16:44
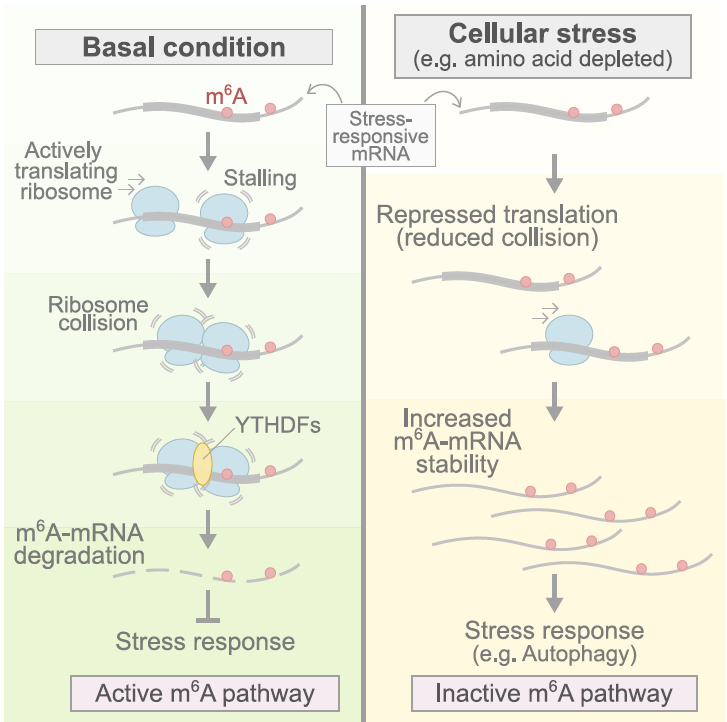
这项研究揭示了一个全新的m⁶A功能模型:核糖体是细胞感知m⁶A标记的“第一道防线”! 它不仅仅是基因蓝图的执行者,更是动态调控m⁶A-mRNA代谢的关键“传感器”。
细胞里蛋白质的“蓝图”——信使RNA(mRNA),除了指导翻译,还能决定自身的命运?它们身上布满了各种神奇的“标记”,其中最普遍的一个叫做N⁶-甲基腺苷(N⁶-methyladenosine, m⁶A)。长久以来,我们知道m⁶A就像一个“死亡标记”,会加速带有这个标记的mRNA的降解。但这似乎有点矛盾:许多在细胞遭遇压力(stress)时急需大量生产的蛋白质,它们的mRNA上也带着m⁶A标记。既然m⁶A会导致降解,那这些关键的“应激”蓝图是怎么在细胞危难时刻“逆势上扬”,大量出现的呢?m⁶A到底是如何发出降解信号的?这个过程背后藏着怎样的“幕后推手”?
5月5日发表在《Cell》上的重磅研究“m6A alters ribosome dynamics to initiate mRNA degradation”,揭开了一个令人意想不到的答案:核糖体(ribosome)!没错,就是那个负责把mRNA翻译成蛋白质的分子机器。这项研究首次揭示,核糖体不仅仅是蓝图的执行者,它更是m⁶A的“第一感知器”!当核糖体在翻译过程中“撞”上mRNA上的m⁶A标记时,竟然会发生剧烈的“卡壳”(stalling),甚至引发后续核糖体的“连环追尾”(collision)。而正是这一系列的“核糖体事故”,启动了mRNA的降解程序。
更精彩的是,这项研究还解释了应激状态下m⁶A-mRNA如何“转危为安”。原来,细胞应激时通常会整体降低翻译速度,导致核糖体移动缓慢,减少了“卡壳”和“撞车”的频率,m⁶A的降解信号因此被削弱,那些带有m⁶A的应激基因mRNA得以稳定并迅速升高,帮助细胞应对挑战。

“刹车”与“油门”:m⁶A降解依赖于“开足马力”的翻译
首先,研究人员想知道,m⁶A导致的mRNA降解是否依赖于mRNA的翻译过程?
他们使用了一种叫做TimeLapse-seq的技术,可以追踪mRNA的合成和降解速率,从而测量mRNA的半衰期(half-life)。研究人员在小鼠胚胎干细胞(mESC)中,使用翻译抑制剂依米丁(emetine)处理细胞,抑制mRNA的翻译。他们发现,依米丁处理后,mRNA的半衰期普遍增加了,这表明在正常条件下,许多mRNA的降解是依赖于翻译的。
有趣的是,这种依米丁引起的mRNA半衰期增加程度,与mRNA上的m⁶A总量密切相关。m⁶A总量越多的mRNA,其半衰期在翻译抑制后增加得越显著,变得越稳定。
为了确认这个现象确实与m⁶A有关,研究人员在Mettl14敲除的小鼠胚胎干细胞中进行了同样的实验。Mettl14是催化mRNA上m⁶A形成的关键酶,Mettl14敲除后细胞内的m⁶A水平极低。结果显示,在Mettl14敲除细胞中,依米丁导致的mRNA稳定化效应大大减弱了。在野生型细胞中,依米丁处理使mRNA半衰期中位数增加了0.32倍,而在Mettl14敲除细胞中仅增加了0.05倍,差异巨大。
这强有力地证明,m⁶A是翻译依赖性mRNA降解的主要驱动力。换句话说,只有当核糖体在mRNA上“开足马力”进行翻译时,m⁶A才能有效地促进mRNA的降解。
核糖体的“惊魂时刻”:m⁶A引发剧烈“卡壳”
既然m⁶A介导的降解依赖于翻译,那么m⁶A是否会直接影响核糖体的翻译过程呢?特别是核糖体在读取含有m⁶A的密码子时会发生什么?
研究人员使用了OTTR核糖体足迹测序(ribosome footprint profiling)技术,这是一种能够高灵敏度地捕捉核糖体在mRNA上位置的方法。他们分析了核糖体在mRNA上不同位置的“足迹”,特别关注核糖体A位点(A-site)位于含有m⁶A的密码子上的情况。通过计算核糖体在m⁶A位点及其周围区域的相对丰度(使用标准化Z分数衡量),研究人员构建了核糖体“卡壳指数”(stalling index),用来量化核糖体在某个位点停留的倾向。
结果令人震惊:在mRNA的编码区(coding sequence, CDS)中,核糖体在含有m⁶A的位点会发生剧烈“卡壳”,其“卡壳”程度比紧邻的非m⁶A对照位点高出约650%! 这个效应比之前一些研究报道的非甲基化对照位点约50%-60%的“卡壳”增加要显著得多,这可能得益于研究人员能够更精确地定位m⁶A位点和更高灵敏度的检测方法。
更重要的是,这种剧烈的核糖体“卡壳”效应完全依赖于m⁶A的存在。在Mettl14敲除细胞中,这些原本会引起剧烈“卡壳”的位点就几乎不引起核糖体富集了。这表明,m⁶A本身是导致核糖体剧烈“卡壳”的直接原因,而不是这些位点原本就有的“卡壳”倾向。
研究还发现,m⁶A所在的具体密码子序列(codon context)也会影响“卡壳”的强度。某些m⁶A密码子(如GA-m⁶A和AA-m⁶A)比其他m⁶A密码子引起更强的“卡壳”。
那么,“卡壳”强度与mRNA降解有什么关系呢?研究人员计算了不同m⁶A密码子引起核糖体“卡壳”的程度与它们对m⁶A介导mRNA降解效果的关联。他们发现,引起核糖体“卡壳”越剧烈的m⁶A密码子,往往也导致mRNA降解越有效,两者之间存在强烈的正相关(相关系数R=0.74)。 作为对照,非甲基化的相似密码子则显示出微弱的负相关。
为了进一步验证,研究人员构建了报告基因,在其中插入了容易引起高“卡壳”的GA-m⁶A密码子簇,或引起低“卡壳”的A-m⁶AC密码子簇。实验显示,含有高“卡壳”GA-m⁶A密码子的报告基因,其mRNA稳定性显著低于含有低“卡壳”A-m⁶AC密码子的报告基因。并且这种稳定性差异在Mettl14敲除细胞中消失了。
这些结果都明确指向:mRNA上的m⁶A通过诱导核糖体剧烈“卡壳”,从而启动了m⁶A介导的mRNA降解。
一“卡”引发“追尾”:核糖体碰撞与独特“足迹”
如此剧烈的核糖体“卡壳”,很自然会让人想到是否会导致后续核糖体的“追尾”或“撞车”(collision)。多个核糖体在一个mRNA上进行翻译,如果前方的核糖体突然停下,后方的核糖体就会追上来,形成“二聚体”(disome)或“三聚体”(trisome)。
研究人员首先在体外模拟了翻译过程,发现含有m⁶A的mRNA在翻译时确实会产生核糖体“二聚体”甚至“三聚体”,而没有m⁶A的mRNA则只产生单个核糖体(monosome)。并且这种“撞车”依赖于翻译起始因子eIF4E的存在。
在活细胞中进行的核糖体足迹测序也证实了这一点:核糖体“二聚体”的足迹在m⁶A位点附近显著富集。 在Mettl3(m⁶A合成酶的另一关键组分)敲除细胞中,通过蔗糖密度梯度离心定量核糖体“二聚体”,发现其数量比野生型细胞减少了约40%。
更令人兴奋的是,研究人员发现m⁶A位点附近的核糖体“二聚体”具有一种独特的构象。通过分析“二聚体”足迹相对于m⁶A位点的精确位置,他们发现,与通常在终止密码子处形成的、足迹末端位于终止密码子下游14-21个核苷酸的“二聚体”不同,m⁶A诱导的“二聚体”中,位于前方的“卡壳”核糖体的足迹末端明显被截短,只在m⁶A位点下游约4-8个核苷酸处。 这种截短现象在单个“卡壳”的核糖体足迹中没有观察到,表明它确实是核糖体“撞车”后才出现的。
“追尾”招募“识别器”:碰撞促进YTHDF蛋白“到位”
核糖体“撞车”是否是连接“卡壳”与m⁶A降解的关键步骤?为了验证这个想法,研究人员利用敲低ASCC3蛋白的方法增加了“撞车”核糖体的持久性。ASCC3是ASC-1复合体的一个亚基,这个复合体能够解聚“撞车”的核糖体。敲低ASCC3会阻止“二聚体”的解聚,让“撞车”核糖体在mRNA上停留更长时间。实验发现,ASCC3敲低显著增强了m⁶A介导的mRNA降解效果。 这强烈暗示,“撞车”核糖体的持久性,即长时间的“连环追尾”,促进了m⁶A介导的mRNA降解。
m⁶A介导的mRNA降解通常需要YTHDF家族蛋白的参与。这些蛋白是m⁶A的“阅读器”,它们结合m⁶A标记后,会招募mRNA降解机器。那么,“撞车”的核糖体是否会促进YTHDF蛋白与m⁶A的结合呢?
研究人员发现,使用依米丁抑制翻译导致的mRNA稳定化,在YTHDF蛋白三重敲除(YTHDF1, YTHDF2, YTHDF3)的细胞中显著减弱。这表明,翻译依赖的m⁶A-mRNA降解路径与YTHDF蛋白介导的路径高度重叠,它们很可能在同一条通路中协同工作。
为了直接检测YTHDF蛋白与“撞车”m⁶A位点的关系,研究人员使用YTHDF2的iCLIP技术(一种高精度地绘制蛋白-RNA相互作用图谱的技术)分析了YTHDF2蛋白的结合位点。他们发现,在发生核糖体“二聚体”的m⁶A位点,YTHDF2蛋白的iCLIP结合信号明显更高,而那些没有“二聚体”的m⁶A位点,YTHDF2结合信号较低。
此外,先前的研究表明YTHDF蛋白可以与核糖体(特别是40S亚基的RACK1)以及18S rRNA的Helix 16区域相互作用。这项研究也证实了YTHDF2与RACK1的相互作用依赖于活跃翻译或80S核糖体结构,并且在Mettl14敲除细胞中减少。有意思的是,18S rRNA的Helix 16区域恰好位于核糖体“撞车”时形成的界面(collision interface)区域。
这些证据共同指向一个模型:核糖体在m⁶A位点“卡壳”并引发“撞车”,形成的独特“撞车”构象可能为YTHDF蛋白的招募提供了便利。 YTHDF蛋白可能通过与“撞车”核糖体界面或直接与m⁶A本身(在“卡壳”核糖体的A位点)相互作用,从而稳定地结合在m⁶A位点,进而招募降解机器启动mRNA降解。
逆境中的“逆袭”:应激下m⁶A-mRNA“转危为安”
我们回到开头提到的问题:m⁶A标记的mRNA编码着许多应激响应基因,在细胞应激时它们水平需要快速升高。这如何与m⁶A促进降解的功能相协调呢?
细胞在面对多种应激(如氨基酸饥饿、内质网应激)时,一个普遍的响应是抑制整体的蛋白质翻译速率,从而节约能量和资源。研究人员猜想,这种应激导致的翻译抑制,是否会影响m⁶A介导的mRNA降解?
他们模拟了细胞应激,比如氨基酸剥夺。氨基酸剥夺确实导致了整体翻译速率的显著下降,在野生型细胞中翻译速率下降了约66%,在Mettl3敲除细胞中下降了约77%。 在这种翻译被抑制的状态下,研究人员再次测量了mRNA的半衰期。
结果显示,氨基酸剥夺显著稳定了含有m⁶A的mRNA,并且这种稳定化效应的程度与mRNA上的m⁶A水平成正比。 而在m⁶A水平极低的Mettl3敲除细胞中,这种应激诱导的稳定化效应也大大减弱了。类似的现象也在内质网应激诱导剂(如图尼卡霉素,tunicamycin)处理后观察到,尽管稳定化效果不如氨基酸剥夺明显。
这说明了一个关键的机制:细胞应激诱导的翻译抑制,降低了核糖体的移动速率,从而减少了核糖体在m⁶A位点的“卡壳”和随后的“撞车”。“撞车”减少了,YTHDF蛋白的招募减少,m⁶A介导的mRNA降解也就减弱了。 这样一来,那些在正常条件下因m⁶A标记而被快速降解的mRNA,在应激发生时由于翻译抑制而得以稳定下来,其水平迅速升高。
模式图(Credit: Cell)
核心观点:核糖体是调控m⁶A代谢的“第一道防线”
那么,应激时m⁶A-mRNA的稳定化升高,对细胞有什么好处呢?研究人员注意到,许多需要在应激时表达的基因(如自噬相关基因)都富含m⁶A标记,并且它们在Mettl3敲除细胞中(m⁶A介导降解受阻)表现出显著的稳定性增加。
自噬(autophagy)是一种细胞在营养饥饿等应激条件下,通过“吃掉”自身损伤或不需要的组分来维持生存的关键过程。研究人员通过检测自噬的关键标志物(如ATG12、ULK1)发现,在Mettl3敲除、m⁶A介导降解受阻的细胞中,即使在氨基酸充足的正常条件下,也已经观察到了自噬水平的升高。在这些细胞中再进行氨基酸剥夺,自噬水平也只轻微增加。
这强烈暗示:仅仅是抑制m⁶A介导的mRNA降解,就足以引发自噬等应激响应。 细胞巧妙地利用翻译抑制这个“开关”:在平时,让核糖体“开足马力”翻译,m⁶A标记就像是“刹车”信号,促使对应的mRNA被降解,保持低水平表达;而在应激时,普遍抑制翻译,核糖体移动缓慢,“刹车”信号不被有效响应,m⁶A-mRNA得以稳定,并快速表达,从而启动自噬等关键的应激响应通路,帮助细胞渡过难关。
这项研究揭示了一个全新的m⁶A功能模型:核糖体是细胞感知m⁶A标记的“第一道防线”! 它不仅仅是基因蓝图的执行者,更是动态调控m⁶A-mRNA代谢的关键“传感器”。核糖体在m⁶A位点的“卡壳”和“撞车”,是连接翻译动力学与m⁶A介导的mRNA降解之间的重要信号。细胞应激时通过普遍抑制翻译,巧妙地“绕过”这个降解通路,确保关键的应激响应基因能够被及时大量表达。
这项研究不仅加深了我们对m⁶A如何调控基因表达的理解,更揭示了核糖体在其中的核心传感作用。未来的研究,特别是利用冷冻电镜(cryo-EM)技术解析含有m⁶A的“撞车”核糖体与YTHDF蛋白相互作用的精确结构,将为我们带来更多激动人心的发现。
所以,下一次当你听到“m⁶A”时,不妨想想那些在mRNA上“卡壳”、“追尾”,默默影响着基因命运的“撞车”核糖体吧!
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


