Cancer Cell:华西科学家发现肿瘤细胞竟靠偷吃血小板来逃脱免疫监视!
来源:奇点糕 2023-02-14 11:15
石虎兵教授团队与马学磊副教授团队合作,揭示了新的免疫检查点HLA-E:CD94-NKG2A,介导循环肿瘤细胞逃脱自然杀伤细胞的免疫监视,并在小鼠实验中使用anti-NKG2A抗体治疗或敲低HLA-E的
循环肿瘤细胞(CTCs)是从实体肿瘤原发病灶或转移灶脱落的肿瘤细胞,作为肿瘤的“种子”在外周血循环中散播,为肿瘤寻找并开拓新的家园。研究表明,癌症患者血液中检测到的CTCs数量与其较差的预后相关[1]。
当然,CTCs在血液循环中的日子也并不好过,需要面对失巢凋亡、血流剪切力、免疫监视等挑战[2]。因此,了解CTCs在血液微环境中的传播机制以及与其它细胞之间的相互作用,有助于我们更好地识破肿瘤的转移计划,并开发出更有效的全新治疗策略。
四川大学华西医院的石虎兵教授团队与马学磊副教授团队联手合作,揭示了CTCs免疫逃逸新机制以及免疫检查点HLA-E:CD94-NKG2A。文章于近日发表于Cancer Cell[3]。
他们发现,CTCs在血液循环中会内化血小板,而血小板来源的RGS18基因会导致细胞表面的HLA-E分子表达上调。CTCs通过HLA-E与自然杀伤(NK)细胞表面CD94-NKG2A分子之间的相互作用,逃脱NK细胞的免疫监视。
阻断HLA-E:CD94-NKG2A的互作,则可以有效抑制胰腺导管腺癌小鼠的肿瘤转移。

论文首页截图
免疫检查点疗法(ICB)已经为多种类型癌症的治疗带来了翻天覆地的变化,而这种疗法的突破性进展,很大程度上得益于人们对肿瘤免疫逃逸机制的认知不断提高提高。
目前,大多研究聚焦于实体肿瘤原发病灶或转移灶中,肿瘤细胞如何利用免疫检查点将自己伪装成健康组织、从而逃过免疫细胞追杀。然而,在CTCs逃窜的路途中,是否有免疫细胞设立关卡拦截、CTCs又是如何逃脱的,尚有许多待解之处。
于是,石虎兵教授团队与马学磊副教授团队合作展开了这项研究。
首先,他们获取未接受治疗的6名胰腺导管腺癌(PDAC)的原发性肿瘤、肝转移灶以及肝门静脉中的血液进行活检,并利用单细胞测序技术(scRNA-seq)等技术,描绘PDAC原发性肿瘤、肝转移灶肿瘤微环境、CTCs的转录组学特征和基因表达差异。
分析结果显示,原发性病灶、肝转移灶中的肿瘤细胞表达模式高度相似,而在血液中游荡的CTCs显得有些特立独行。
不同于实体病灶中的肿瘤细胞,大量血小板相关基因在CTCs中显著富集。在CTCs中过表达最多的100个基因中,有32个被鉴定为血小板相关基因。更重要的是,与原发性病灶、肝转移灶相比,CTCs中的免疫相关信号通路更加活跃,提示外周血循环中的CTCs与免疫细胞之间具有潜在的相互作用。
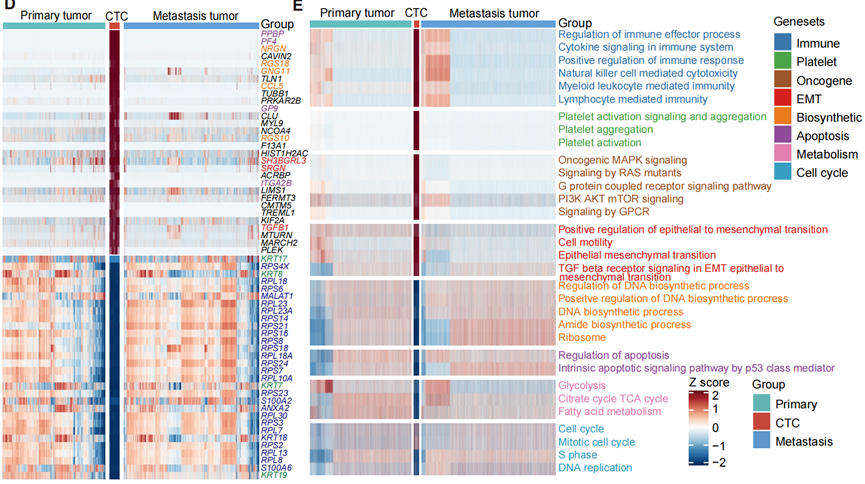
CTCs和原发/转移性病变肿瘤细胞之间的基因表达差异
在原发或转移病灶的肿瘤微环境中,肿瘤细胞与多种类型免疫细胞周旋,如CD8+T细胞、巨噬细胞、NK细胞等。那么,在外周血循环中散播时,CTCs又会与哪些免疫细胞纠缠在一起呢?
基于CellPhoneDB数据库,研究者们对肿瘤细胞与不同类型免疫细胞之间的相互作用进行探索。
结果发现,CTCs与众多免疫细胞之间的关系没有那么错综复杂,主要通过其表面的HLA-E分子与NK细胞上的CD94-NKG2A分子发生特异性的相互作用。
值得注意的是,不管是在原发或转移病灶肿瘤微环境中,还是在血液中,大多数NK细胞都表达CD94-NKG2A。只不过,HLA-E在CTCs上的表达水平要远高于实体病灶中的肿瘤细胞。
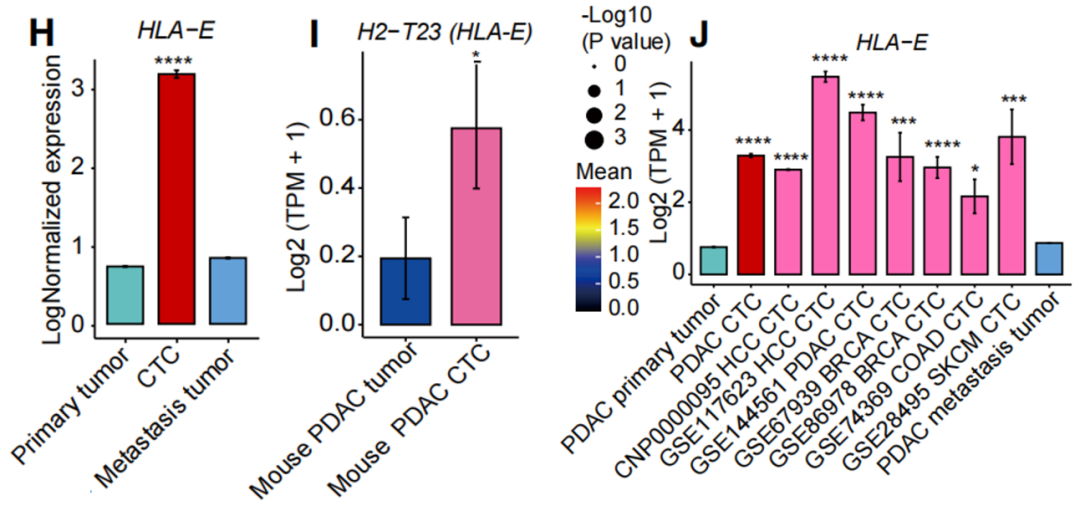
CTCs上HLA-E表达水平更高
接下来,研究者们利用体外实验和小鼠实验验证表明,使用抗NKG2A抗体治疗或使用遗传学手段敲低HLA-E的表达来阻断CTCs和NK细胞的结合和互作,能够显著抑制PDAC肿瘤转移,并显著提高发生肺转移的PDAC小鼠在接种肿瘤后第27天的总生存率。
另外,阻断HLA-E:CD94-NKG2A之间的互作,其抗肿瘤效果仅局限于在血液循环中流动的CTCs,那些已经成功转移阵地、定植在新器官的肿瘤细胞不受影响。
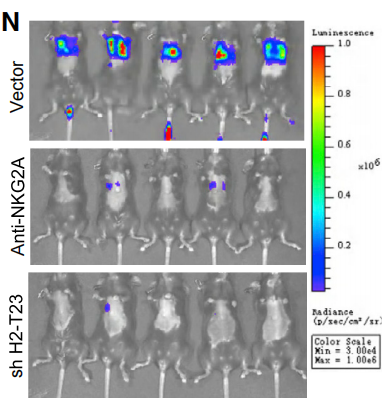
使用抗NKG2A抗体治疗或敲低HLA-E的表达,可抑制肿瘤转移
这些表明,在外周血循环中,CTCs可通过HLA-E:CD94-NKG2A来逃避NK细胞的免疫监视。
不仅如此,研究者们还有了意外收获。
通常认为,CTCs会让血小板黏附在自己身上形成物理“盾牌”,以抵御免疫毒性细胞的攻击。此外,贴在CTCs身上的血小板还能分泌多种细胞因子促进CTCs存活[4,5]。
然而,这次研究者们发现,事情的真相并非如此——血小板不是CTCs的“人质”,而是CTCs的口粮。CTCs竟然靠偷吃血小板来强化自己,从而逃避免疫监测。

CTCs吃了血小板
通过摄入血小板,CTCs可以获得血小板来源的蛋白质、mRNA等生物大分子。其中,血小板来源的RGS18基因帮CTCs做了几张“假通行证”。CTCs内化血小板后,RGS18通过调控CTCs细胞内的AKT-GSK3b-CREB信号通路,导致CTCs细胞表面的HLA-E表达上调,从而帮助CTCs借助HLA-E与NK细胞表面CD94-NKG2A之间的互作,在NK细胞的免疫监视下逃之夭夭。
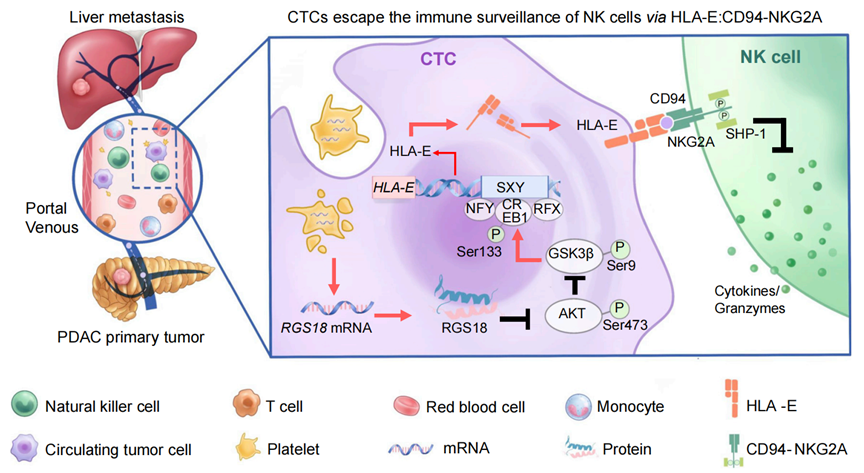
机制图
在小鼠实验中可以观察,在接种肿瘤后第14天时,接种过表达RGS18的人胰腺导管腺癌细胞(SU86.86)的小鼠,肿瘤向肝脏转移;而接种不表达RGS18的人胰腺导管腺癌细胞(SU86.86)的小鼠,肿瘤未发生明显肝转移。
也就是说,RGS18通过上调CTCs中抑制性免疫检查点分子HLA-E,在促进肿瘤转移中发挥关键作用。

RGS18基因与肿瘤转移相关
总体来说,石虎兵教授团队与马学磊副教授团队合作,揭示了新的免疫检查点HLA-E:CD94-NKG2A,介导循环肿瘤细胞逃脱自然杀伤细胞的免疫监视,并在小鼠实验中使用anti-NKG2A抗体治疗或敲低HLA-E的表达,成功抑制肿瘤转移。
研究者们表示,针对HLAE:CD94-NKG2A的治疗方案,可能对原发肿瘤或已发生转移的肿瘤不具有可观的疗效。虽然大多数NK细胞特异性表达抑制性受体CD94,但是HLA-E在原发或转移灶中表达相对较低,而在CTCs中表达上调。这或许可以解释目前抗CD94抗体单药治疗在临床试验中的不理想结果。
另一方面,这项研究强调了血小板以及RGS18基因在CTCs免疫逃逸过程中起到的关键作用。CTCs内化血小板后,这些“新补给”可直接或通过影响转录来调控CTCs的细胞内信号转导,这为血小板相关研究提供了全新方向。
参考文献:
[1]Pereira-Veiga, T., Schneegans, S., Pantel, K., & Wikman, H. (2022). Circulating tumor cell-blood cell crosstalk: Biology and clinical relevance. Cell reports, 40(9), 111298. https://doi.org/10.1016/j.celrep.2022.111298
[2]https://www.cell.com/cancer-cell/pdf/S1535-6108(23)00001-6.pdf
[3]Ward, M.P., E Kane, L., A Norris, L., Mohamed, B.M., Kelly, T., Bates, M., Clarke, A., Brady, N., Martin, C.M., Brooks, R.D., et al. (2021). Platelets, immune cells and the coagulation cascade; friend or foe of the circulating tumour cell? Mol. Cancer 20, 59. https://doi.org/10.1186/s12943-021- 01347-1.
[4] Labelle, M., and Hynes, R.O. (2012). The initial hours of metastasis: the importance of cooperative host-tumor cell interactions during hematogenous dissemination. Cancer Discov. 2, 1091–1099. https://doi.org/10. 1158/2159-8290.Cd-12-0329.
[5]Gay, L.J., and Felding-Habermann, B. (2011). Contribution of platelets to tumour metastasis. Nat. Rev. Cancer 11, 123–134. https://doi.org/10. 1038/nrc3004.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


