EMBO Reports:章海兵团队等揭示T细胞免疫稳态与衰老的作用关系
来源:生物世界 2023-11-20 09:43
中国科学院上海营养与健康研究所章海兵课题组等在 EMBO Reports 期刊发表了题为:Excessive apoptosis of Rip1-deficient T cells leads to
中国科学院上海营养与健康研究所章海兵课题组等在 EMBO Reports 期刊发表了题为:Excessive apoptosis of Rip1-deficient T cells leads to premature aging 的研究论文。
该研究发现,在小鼠T细胞中特异性敲除Rip1基因(Rip1tKO)会导致T细胞过度死亡,并呈现出早期胸腺萎缩,外周初始T细胞减少,记忆T细胞比例增加等类似衰老小鼠的T细胞表型,并在6个月龄左右发生全身系统性早衰,通过进一步构建Fadd基因敲除阻断Rip1缺失诱导的T细胞凋亡的双基因敲除小鼠,能够逆转Rip1tKO小鼠的T细胞异常以及小鼠全身系统性的早衰,为调控T细胞稳态延缓衰老或衰老相关疾病提供了理论基础。

Receptor-Interacting Protein Kinase 1(RIP1/RIPK1)是决定细胞死亡与存活的关键调控蛋白,研究人员通过构建T细胞特异性敲除RIP1基因的小鼠(Rip1tKO),发现Rip1tKO小鼠相对于同龄的野生型小鼠,呈现出系统性的早衰特征,包括过度的炎症,弓背,毛发稀疏,身体机能下降,骨质疏松、肌少症等多种与年龄相关的表型,同时行为及认知能力出现显著下降,寿命也较野生型小鼠显著缩短。
机制研究发现,RIP1的缺失导致T细胞的凋亡增加,并促进T细胞向TH1和TH17亚型分化,诱导组织器官炎症水平增高,进一步促进组织器官衰老标志物表达升高。通过在Rip1tKO小鼠的基础上进一步构建Fadd基因敲除的小鼠阻断T细胞的凋亡,发现FaddtKORip1tKO双基因敲除小鼠能够恢复外周原始T细胞以及记忆T细胞稳态平衡,并能逆转Rip1tKO小鼠的胸腺萎缩以及全身系统性的早衰表型,同时延长Rip1tKO小鼠的寿命至野生型小鼠水平,而阻断T细胞的程序性坏死小鼠(Rip1tKORip3-/-和Rip1tKOMlkl-/-)却仍表现出与Rip1tKO小鼠相似的系统性衰老表型,提示Rip1tKO小鼠是T细胞过度凋亡导致外周原始T细胞的减少以及记忆T细胞的比例增加,促进了组织的炎症水平升高及组织细胞衰老,最终导致个体全身系统性的早衰发生。
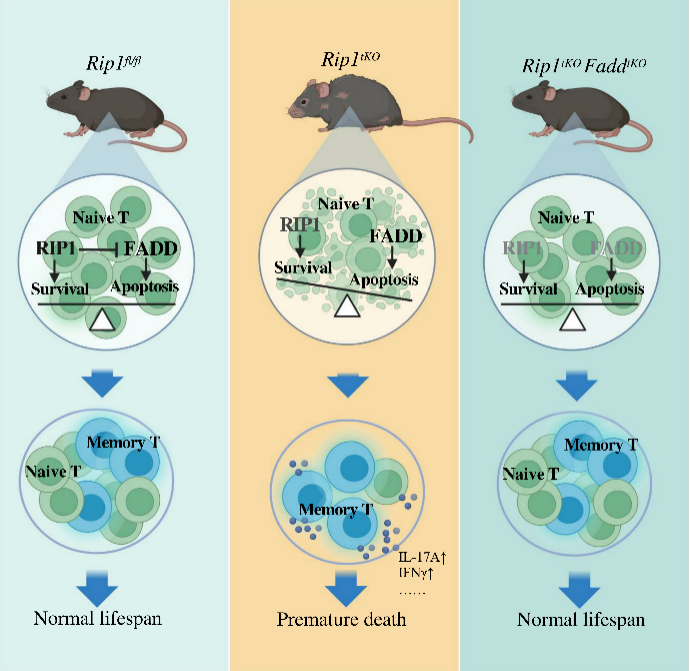
图注:T细胞稳态失衡与个体衰老的关系
综上所述,T细胞稳态是机体抵抗衰老维持健康的关键,Rip1tKO小鼠的系统性早衰不仅为进一步研究T细胞免疫稳态调控衰老以及衰老相关疾病的机制提供了新的动物模型,而且由于正常衰老小鼠的T细胞也呈现凋亡的增加,因此,也为进一步研究补充原始T细胞或抑制原始T细胞的凋亡来延缓衰老及治疗衰老相关疾病的潜在应用提供了基础。
中国科学院上海营养与健康研究所博士生王玲霞为该论文的第一作者,章海兵研究员和周犇研究员,以及上海交通大学医学院附属瑞金医院麻醉科罗艳教授和上海市第六人民医院神经内科王修哲博士为该论文的共同通讯作者。该工作得到了上海市第六人民医院赵玉武教授,中国科学院上海免疫与感染研究所王海坤研究员,中国科学院上海营养与健康研究所丁秋蓉研究员等的大力支持。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


