Mater Today Bio:干细胞球联手纳米颗粒水凝胶精准改善糖尿病创面环境,加速伤口愈合新突破
来源:生物谷原创 2025-07-08 10:53
本研究将负载去铁胺的介孔聚多巴胺纳米颗粒与三维脂肪间充质干细胞球结合,包裹于水凝胶中,可改善糖尿病创面微环境,加速愈合,为糖尿病创面治疗提供新方法。
糖尿病已成为全球高发的慢性疾病,其引发的慢性难愈性创面是临床治疗的一大难题。这类创面因免疫功能低下、慢性炎症、氧化应激及血管再生障碍等问题,严重阻碍正常愈合过程,传统治疗手段效果往往不理想,患者完全愈合率不足50%,且存在恢复周期长、治疗成本高等问题。
近期,发表在Mater Today Bio上的一项研究DFO-loaded PDA nanoparticles facilitated 3D stem cell spheroids for diabetic wound repair by normalizing the pathological microenvironment为糖尿病创面修复带来了新突破,该研究将三维脂肪间充质干细胞球(3D-ADSCs)与负载去铁胺(DFO)的介孔聚多巴胺纳米颗粒(M@D)相结合,并包裹在明胶甲基丙烯酰胺(GelMA)水凝胶支架中,构建出一种功能性生物复合材料,为改善糖尿病创面微环境、加速愈合提供了创新策略。

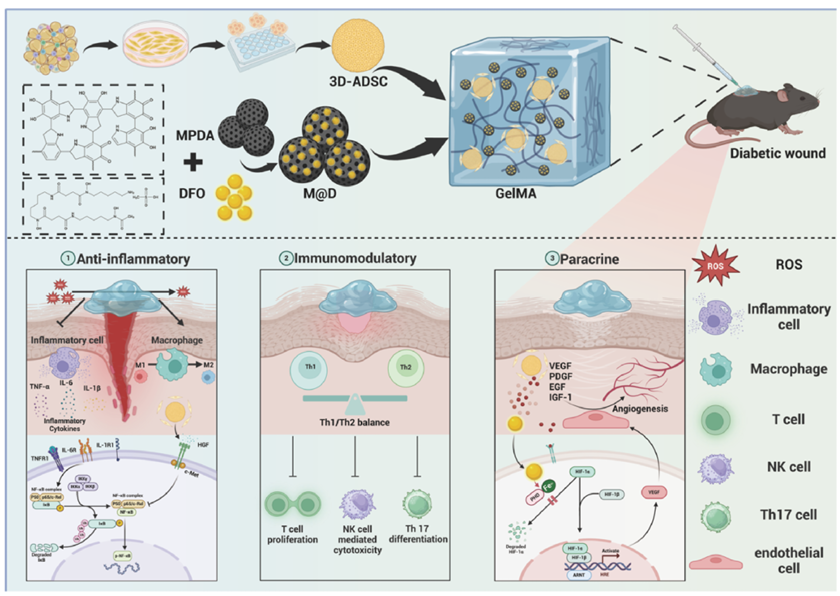
图 1. S&M@D水凝胶通过抑制氧化应激、抗炎、免疫调节和旁分泌作用促进糖尿病创面愈合的示意图
研究中所使用的M@D纳米颗粒设计独具匠心,既能有效清除活性氧(ROS),又能持续释放DFO。这一特性可显著减轻创面氧化应激反应,为血管生成创造有利条件,进而改善局部创面微环境。而这种优化后的环境,又能大幅提升3D-ADSCs球的存活能力、旁分泌活性及再生潜能。同时,3D-ADSCs球本身也能发挥强大的旁分泌、抗炎及免疫调节作用,在组织修复中扮演关键角色。M@D纳米颗粒与3D-ADSCs在GelMA水凝胶中的协同作用,不仅缓解了氧化应激导致的细胞损伤,还增强了血管化程度和营养供应,从而加速了糖尿病创面的愈合。
从具体研究结果来看,在3D-ADSCs球的分离与表征方面,研究人员通过酶消化法从大鼠腹股沟脂肪中成功分离出脂肪间充质干细胞(ADSCs),流式细胞术证实其高纯度,且具有成骨、成脂、成软骨的多向分化潜能。利用AggreWell™400板培养出的3D-ADSCs球,经活死染色和F-actin染色显示细胞活力高,细胞骨架完整,且在形成过程中发生明显的紧缩现象,细胞间黏附增强,保持了良好的活性和功能。
对于MPDA和M@D纳米颗粒的表征,TEM和SEM观察显示MPDA纳米颗粒具有独特的碗状介孔结构,有利于DFO的高效负载,DFO加载后纳米颗粒的形貌发生相应变化。粒度分析和zeta电位测定证实了M@D纳米颗粒的成功制备,红外光谱进一步验证了DFO在MPDA中的有效包裹,其负载效率达49.8%。
抗氧化能力评估显示,MPDA纳米颗粒对DPPH和超氧阴离子自由基具有浓度依赖性的清除效果,DFO本身也展现出优异的抗氧化活性,能直接清除多种自由基,这为减轻创面氧化应激提供了有力支持。
M@D水凝胶的表征结果显示,其具有交联多孔结构,有利于吸收创面渗出液,且具备自修复性能,能在机械应力下维持结构完整性。同时,该水凝胶还表现出剪切变稀行为,具有良好的可注射性,便于填充不规则创面。在药物释放方面,M@D水凝胶在酸性环境(类似糖尿病创面环境)中DFO释放更快,24小时释放65.23%,96小时累计释放达90.61%,能更好地适应创面需求。
生物相容性及保护作用研究表明,M@D水凝胶在氧化应激条件下能显著提高ADSCs的存活率,且不影响3D-ADSCs球的多能性。同时,M@D纳米颗粒能有效螯合细胞内铁离子,抑制铁死亡,恢复GPX4表达,保护细胞免受氧化损伤,还能清除细胞内ROS,保护线粒体完整性。
体外伤口愈合活性评估发现,M@D水凝胶提取物与3D-ADSCs球上清液的组合(S&M@D)能显著促进L929成纤维细胞和HUVEC内皮细胞的迁移,在Transwell和划痕实验中均表现出最佳效果。在促血管生成方面,S&M@D组能诱导HUVEC形成密集且有序的毛细血管样管状网络,上调HIF-1α和VEGF的表达,显示出最强的血管生成潜力。
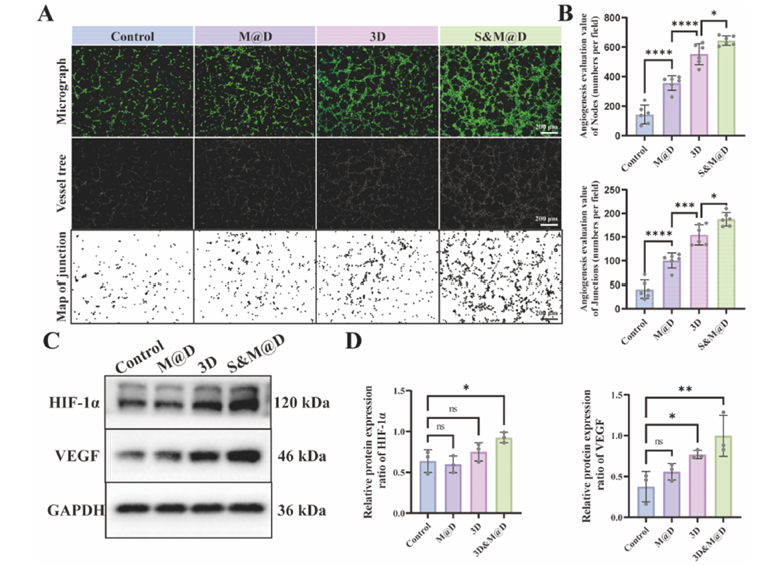
图 2:不同处理下的血管生成能力评估
巨噬细胞极化实验显示,3D-ADSCs球上清液和M@D水凝胶提取物能有效促进LPS诱导的RAW264.7巨噬细胞从促炎的M1表型向抗炎的M2表型极化,降低促炎因子表达,升高抗炎因子水平,有助于减轻创面过度炎症反应。
在3D-ADSCs球旁分泌活性保护方面,M@D水凝胶提取物在高ROS环境下能改善3D-ADSCs球的生长因子分泌,包括PDGF、VEGF、EGF和IGF-1等,且3D培养的ADSCs分泌VEGF的量显著高于2D培养。
体内糖尿病创面愈合实验中,STZ诱导的糖尿病小鼠模型显示,S&M@D凝胶处理组创面愈合速度显著加快,较其他组提前约7天完成愈合。激光多普勒成像显示该组创面血流灌注恢复更好,免疫荧光染色显示CD31和α-SMA表达最高,血管生成更活跃。组织学分析显示S&M@D组上皮再生更完全,胶原纤维排列更有序,胶原蛋白沉积更多,炎症反应更轻,巨噬细胞向M2表型极化更明显,细胞增殖活性更高。
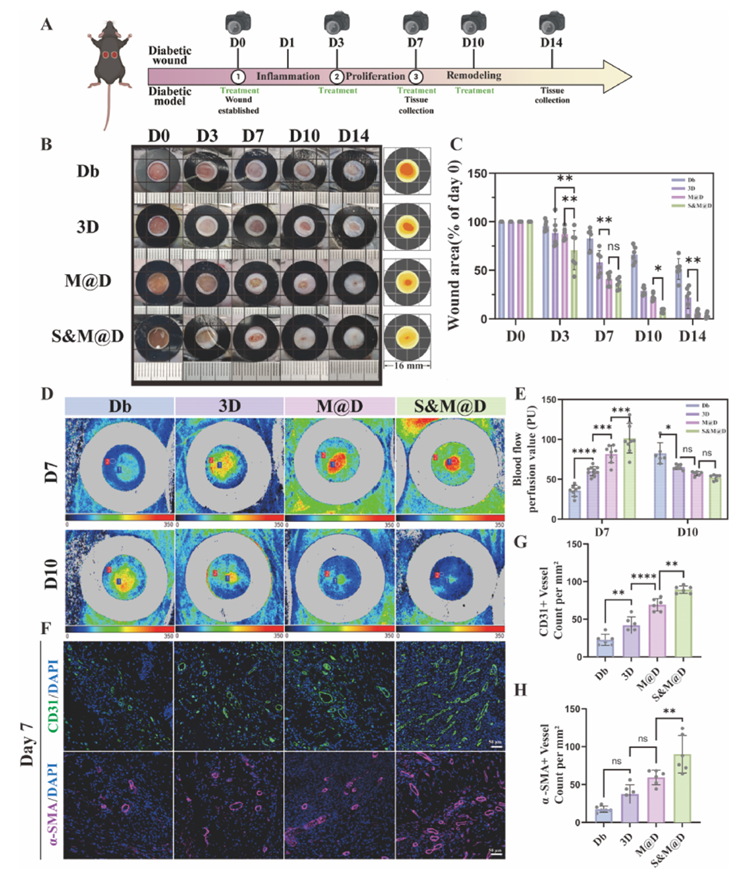
图 3:负载去铁胺的介孔聚多巴胺与三维脂肪间充质干细胞球水凝胶能有效加速糖尿病创面愈合
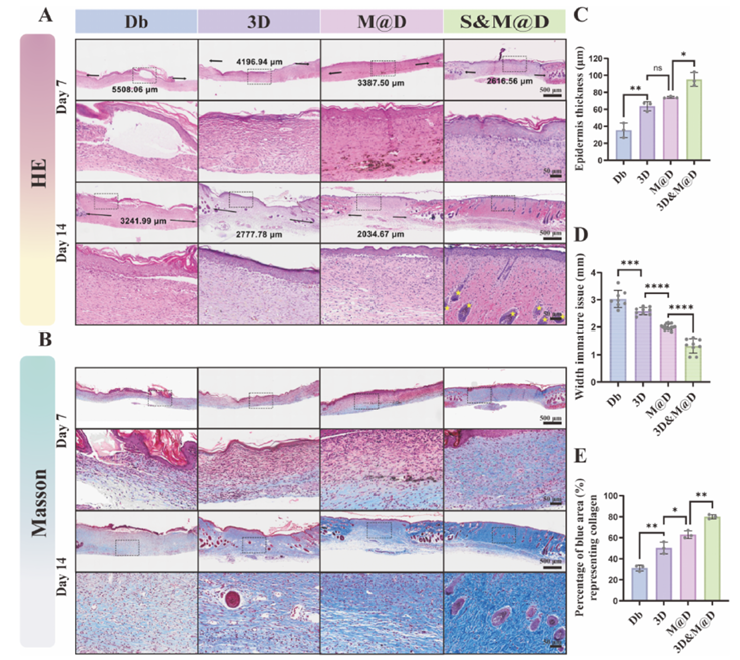
图 4:体内负载去铁胺的介孔聚多巴胺与三维脂肪间充质干细胞球水凝胶促进糖尿病创面愈合和毛囊再生
机制研究通过RNA测序发现,S&M@D处理显著下调了与炎症和免疫反应相关的通路,如NF-κB信号通路,Western blot验证显示p-NF-κB和p-IκBα水平显著降低,表明其能减轻炎症反应,促进创面从炎症期向增殖和重塑期过渡。生物相容性评估证实S&M@D无明显器官毒性,血液相容性良好。
综上所述,这项研究通过将M@D纳米颗粒与3D-ADSCs球结合,充分发挥了两者的协同作用,有效改善了糖尿病创面的病理微环境,加速了创面愈合。这一创新疗法为糖尿病创面的临床治疗提供了全新思路,有望推动干细胞疗法与材料科学在慢性创面治疗中的应用,为众多糖尿病患者带来福音,未来在再生医学领域具有广阔的应用前景。(生物谷Bioon.com)
参考文献:
Luo T, Zhu P, Li S, et al. DFO-loaded PDA nanoparticles facilitated 3D stem cell spheroids for diabetic wound repair by normalizing the pathological microenvironment. Mater Today Bio. 2025;33:101973. Published 2025 Jun 14. doi:10.1016/j.mtbio.2025.101973
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


