Cell Metab:肖玲等揭示棕色脂肪中的m⁶A mRNA甲基化通过独立于UCP1的前列腺素信号调控全身胰岛素敏感性
来源:生物探索 2024-09-12 09:37
该研究揭示了m6A通过调控前列腺素在棕色脂肪中的合成,进而影响全身代谢的新机制,拓展了m6A及其他表观遗传修饰在代谢调控中的研究思路。
棕色脂肪组织(BAT)因其通过解偶联蛋白1(UCP1)产生热量,成为治疗和预防肥胖及相关代谢疾病的潜在靶点。研究表明,冷刺激激活的BAT可以通过能量消耗减少体脂,改善心脏代谢健康,特别在超重和肥胖个体中效果显著。尽管BAT的产热功能备受关注,近年来越来越多的证据表明,BAT还通过分泌各种有益因子("BATokine",如肽类、蛋白质、脂质、miRNA等)对全身代谢产生积极调节。其中,一类被称为“BAT lipokine”的脂质因子尤为重要【1,2】,它与胰岛素敏感性、葡萄糖耐量以及炎症调节密切相关。
m6A(N6-甲基腺嘌呤)是RNA中最常见的内部甲基化修饰之一,广泛存在于真核生物的mRNA和非编码RNA中,在RNA剪接、翻译、稳定性和降解等过程中发挥重要作用。m6A修饰与干细胞分化、肿瘤发生、免疫调控和代谢紊乱等生理与病理过程密切相关。尽管已知m6A在棕色脂肪产热中具有重要作用,但m6A是否通过调控棕色脂肪分泌的"BATokine"影响全身代谢尚不清楚。
2024年9月9日,哈佛医学院及Joslin糖尿病研究中心 (Joslin Diabetes Center)的Rohit N. Kulkarni教授团队在Cell Metabolism在线发表了题为m6A mRNA Methylation in Brown Fat Regulates Systemic Insulin Sensitivity via an Inter-Organ Prostaglandin Signaling Axis Independent of UCP1的研究成果。
该研究通过基因组学、甲基化组学和脂质组学等多组学手段,首次揭示了:1. 由甲基转移酶14(METTL14)介导的m6A修饰,通过负向调控BAT中前列腺素合成酶的表达,抑制了前列腺素PGE2和PGF2α的合成;2. 敲除BAT中的METTL14显著提高了PGE2和PGF2α的水平,从而改善了胰岛素敏感性,促进了白色脂肪棕色化,并降低了肥胖小鼠体重;3. 揭示了PGE2和PGF2α作为新型胰岛素增敏剂的新分子机制。

研究者首先检测了不同胰岛素抵抗小鼠模型中BAT的m6A甲基转移酶水平,发现胰岛素抵抗小鼠BAT中METTL14高表达,提示其与胰岛素敏感性负相关。进一步通过特异性敲除小鼠BAT中的METTL14,结果显示,敲除后小鼠全身多种代谢组织的胰岛素敏感性显著提升。这表明METTL14的缺失能够通过BAT与其他代谢组织的相互作用改善胰岛素敏感性,且不依赖于UCP1的产热功能。
通过脂质组学分析,研究者发现,在METTL14缺失的小鼠棕色脂肪组织及人源性棕色脂肪细胞中,PGE2和PGF2α的水平显著升高。进一步研究表明,PGE2和PGF2α能够显著增强代谢细胞的胰岛素敏感性。在肥胖小鼠模型中注射这两种前列腺素,表现出胰岛素增敏及抗肥胖的表型特征,并伴随白色脂肪组织的米色化现象。值得注意的是,PGE2和PGF2α的血液水平在肥胖及胰岛素抵抗人体中与胰岛素敏感性呈显著正相关。机制研究进一步揭示,PGE2和PGF2α通过特异性GPCR介导的信号通路,抑制AKT磷酸酶的活性,从而提高胰岛素敏感性。
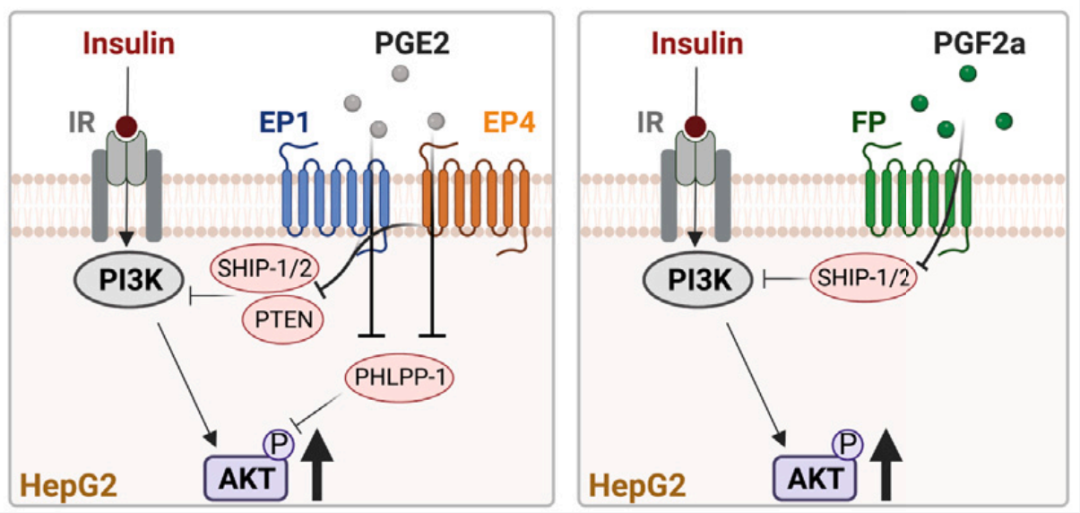
模式图(Credit: Cell Metabolism)
为了进一步研究m6A如何调控BAT中前列腺素的合成,研究者结合基因组学和m6A甲基化组学,发现METTL14的缺失通过降低m6A甲基化水平,增强了前列腺素合成酶基因的稳定性,增加了其表达。
综上所述,该研究揭示了m6A通过调控前列腺素在棕色脂肪中的合成,进而影响全身代谢的新机制,拓展了m6A及其他表观遗传修饰在代谢调控中的研究思路。
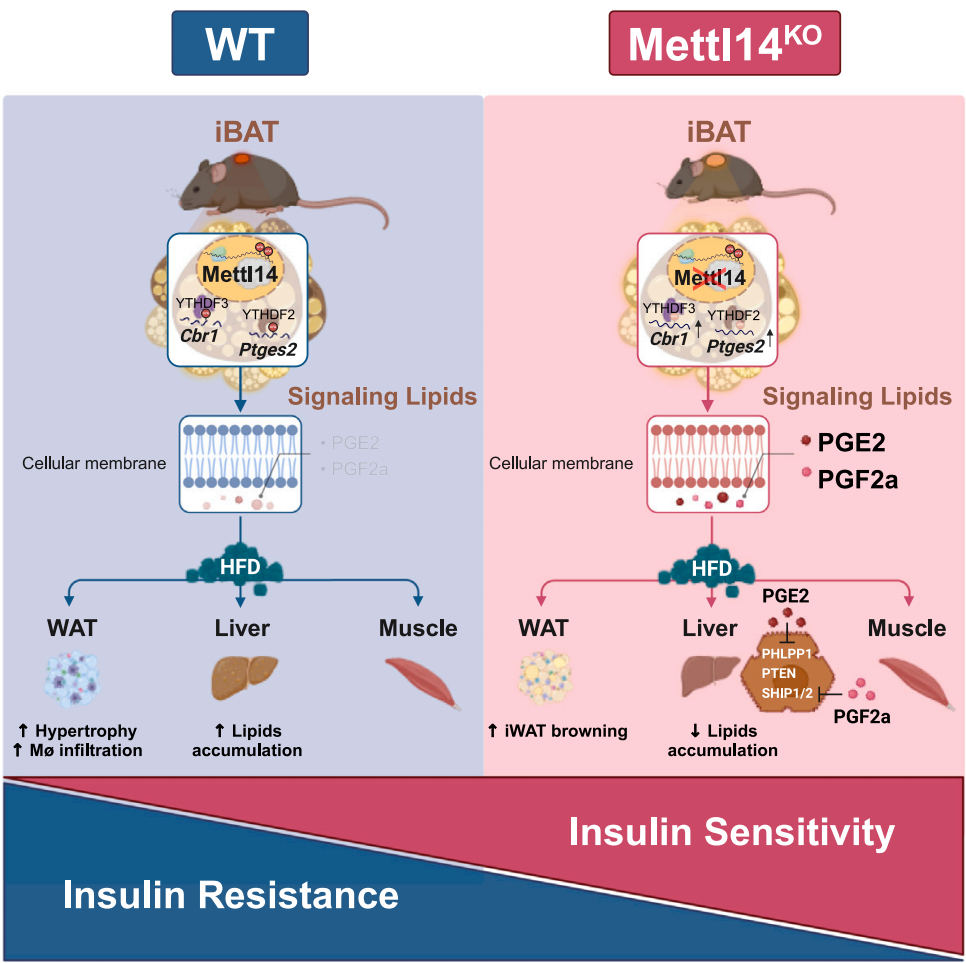
模式图(Credit: Cell Metabolism)
参考文献:
1 SHAMSI, F.; WANG, C. H.; TSENG, Y. H. The evolving view of thermogenic adipocytes - ontogeny, niche and function. Nat Rev Endocrinol, v. 17, n. 12, p. 726-744, Dec 2021. ISSN 1759-5029 (Print)
1759-5029.
2 CYPESS, A. M. Reassessing Human Adipose Tissue. N Engl J Med, v. 386, n. 8, p. 768-779, Feb 24 2022. ISSN 0028-4793.
3 DE JESUS, D. F. et al. m(6)A mRNA Methylation Regulates Human β-Cell Biology in Physiological States and in Type 2 Diabetes. In: (Ed.). Nat Metab. Germany, v.1, 2019. p.765-774. ISBN 2522-5812 (Electronic) 2522-5812 (Linking).
4 D, F. D. J. et al. Redox regulation of m(6)A methyltransferase METTL3 in β-cells controls the innate immune response in type 1 diabetes. Nat Cell Biol, v. 26, n. 3, p. 421-437, Mar 2024. ISSN 1465-7392.
5 KAHRAMAN, S. et al. m6A mRNA Methylation Regulates Early Pancreatic β-Cell Differentiation. bioRxiv, p. 2023.08.03.551675, 2023. Disponível em: <https://www.biorxiv.org/content/biorxiv/early/2023/08/03/2023.08.03.551675.full.pdf >.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


