Nature子刊:何川团队开发RNA结合蛋白靶点检测新方法——ARTR-seq
来源:生物世界 2024-01-11 11:31
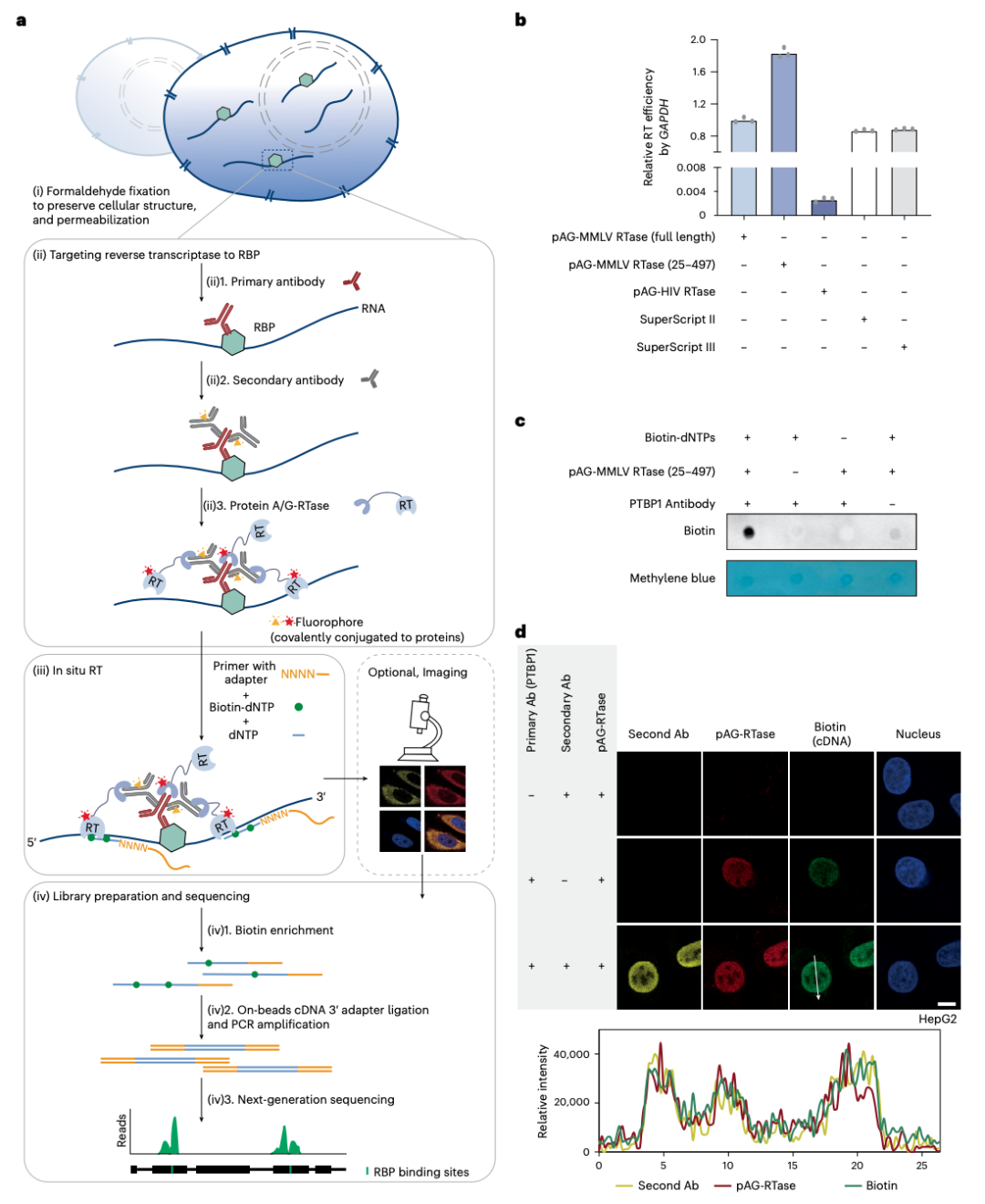
在这项研究中,何川团队为了克服现有方法的局限性,提出了一种基于逆转录酶(RT)的RBP结合位点测序方法——ARTR-seq,通过原位逆转录酶捕获RBP-RNA相互作用。
芝加哥大学何川教授团队在 Nature Methods 期刊发表了题为:Profiling of RNA-binding protein binding sites by in situ reverse transcription-based sequencing 的研究论文。

广泛使用的识别RBP的靶点的方法是基于特定RBP及其结合RNA的免疫沉淀(IP),通过直接RNA免疫沉淀(RIP)或共价捕获辅助的交联沉淀(CLIP),通过RIP或CLIP使用靶向RBP的抗体来富集与特定RBP结合的底物RNA,然后进行高通量测序来描绘整个转录组中的RBP靶点。CLIP-seq通过共价交联捕获底物RNA上的RBP结合位点。RNase处理消化RNA的无RBP区域,提高了结合位点检测的分辨率。CLIP-seq变体如PAR-CLIP或eCLIP提高了交联效率、特异性或结合位点分辨率。
虽然这些方法有效且广泛使用,但也有局限性。由于免疫沉淀效率低,它们通常需要大量的起始材料,基于CLIP的方法中的紫外线交联是一种低效率的化学反应。最近报道的tRIP-seq和LACE-seq可以应用于低输入样本,但以降低文库复杂度为代价。
TRIBE和STAMP方法将RBP与RNA碱基编辑器融合,在RBP结合位点附近引入突变,绕过免疫沉淀来识别RBP结合位点。这些方法可以轻松应用于活细胞中研究RBP结合,并以有限的材料达到单细胞水平,然而,这些基于碱基编辑的方法仍然存在局限性。它们需要在生殖细胞系或细胞系中插入碱基编辑蛋白,从而进行基因组操作,阻碍了它们在原代细胞和组织中的应用。诱导编辑蛋白的表达通常需要大约24小时或更长时间,无法用于监测RBP与RNA的动态结合。此外,这些碱基编辑器有自己的序列偏好,可能会改变目标RBP的天然结合谱。
近期还有研究团队开发了基于CUT&Tag策略的新方法——RT&Tag,这种方法可以识别聚腺苷酸RNA中的RBP结合,但对非聚腺苷酸RNA和胞质RBP结合无效。而且由于其使用的Tn5酶在异源双链上的效率较低,需要25000-100000个细胞核才能获得足够的转录组范围的结合信号。
在这项研究中,何川团队为了克服现有方法的局限性,提出了一种基于逆转录酶(RT)的RBP结合位点测序方法——ARTR-seq,通过原位逆转录酶捕获RBP-RNA相互作用。
实验结果显示,ARTR-seq可以灵敏描绘RBP靶点,测序质量良好,使用仅20个细胞或单个组织切片即可。此外,ARTR-seq程序中可以轻松添加成像步骤,提供RBP的直接空间信息。通过ARTR-seq,研究团队展示了剪接因子和RNA m6A修饰的YTH家族阅读器蛋白的独特结合模式。ARTR-seq无偏倚地检测了细胞质和细胞核中RBP与RNA的结合,并测量了RBP在RNA底物上的结合强度。此外,ARTR-seq可以在10分钟的时间尺度上监测G3BP1在应激颗粒(SG)组装过程中的动态RNA结合。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


