《细胞·代谢》:脂肪肝促进肠癌肝转移的机制,找到了!
来源:奇点糕 2023-07-09 13:00
该研究验证了脂肪肝中由肝细胞衍生的EVs在结直肠癌肝转移过程中的重要作用,并进一步揭示了其具体分子机制,为日后结直肠癌肝转移的治疗提供了新的思路。
脂肪肝患者更易发生结直肠癌肝转移的机制找到了!
近期,美国西达赛奈医学中心的Ekihiro Seki研究团队发表了一项研究,发现脂肪肝不仅会对肝脏本身产生影响,还能通过释放细胞外囊泡(EVs)创造一种有利于结直肠癌转移的肝脏微环境。
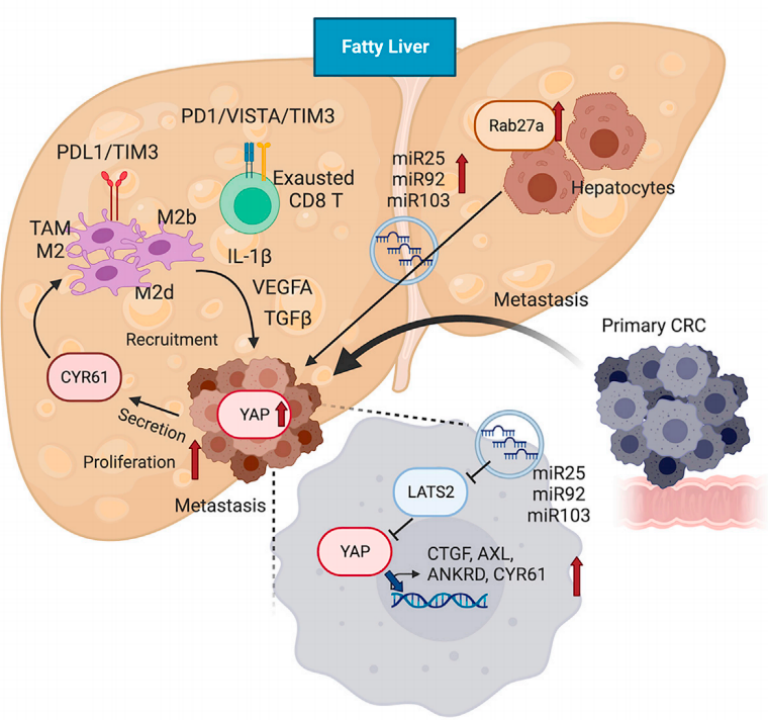
机制上,脂肪肝会上调Rab27a表达,增加肝脏细胞产生EVs,这些EVs将含有调节YAP信号通路的微小RNA(miRNA)转移到癌细胞中,通过抑制LATS2基因的表达来激活YAP信号通路。YAP信号通路的激活促进了M2巨噬细胞的浸润和CYR61的产生,形成了一个免疫抑制的微环境,进一步加速了结直肠癌的肝转移。
研究发表在《细胞·代谢》上,华中科技大学同济医学院的汪志军及涂炜也是本文的共同第一作者[1]。

论文首页截图
结直肠癌是最常见的恶性肿瘤之一,也是癌症相关死亡的第二大原因。肝脏是结直肠癌最常见的转移部位,约有70%的结直肠癌患者都会发生肝转移。肥胖和非酒精性脂肪肝病(NAFLD)是结直肠癌的重要危险因素。
近年来有不少研究显示,脂肪肝增加了结直肠癌肝转移的发生风险,影响患者预后,但其背后的分子机制还不是很清楚。
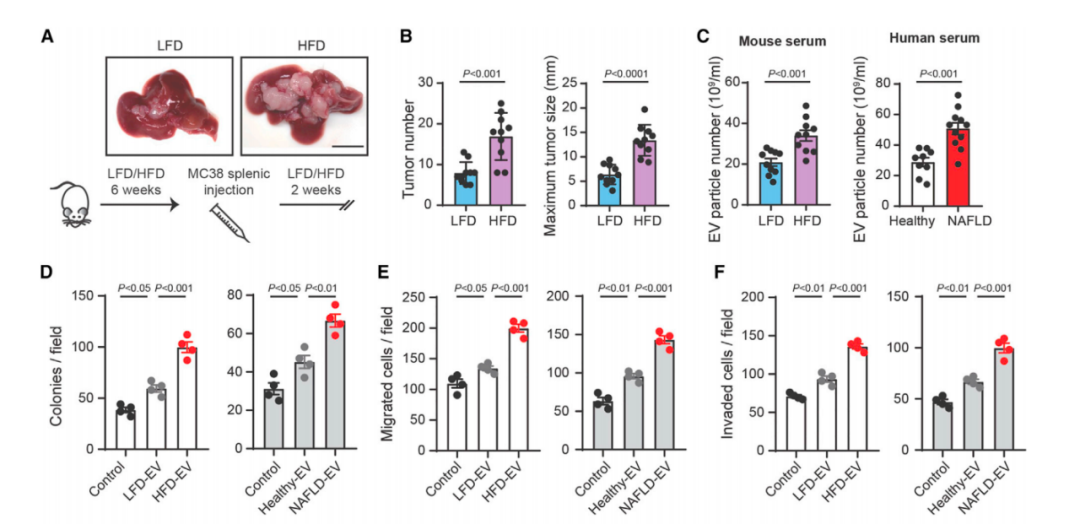
为了进一步探究脂肪肝促进结直肠癌肝转移的机制,研究人员建立了有或没有脂肪肝的结直肠癌肝转移小鼠模型(野生[wt]小鼠喂食高脂饮食[HFD]和低脂饮食[LFD]6周,脾脏注射MC38结直肠癌细胞2周)。
结果发现,HFD增加了转移性肿瘤的数量和大小,同时,小鼠血清中的EVs数量也变多了。鉴于EVs能促进癌症生长,研究人员用HFD小鼠血清中的EVs处理MC38细胞,结果发现癌细胞的增殖、迁移和侵袭能力的确变强了。
EVs促进结直肠癌肝转移
在人体中,研究人员同样观察到NAFLD患者血清中EVs的数量比健康人多的多。更重要的是,NAFLD患者血清中EVs也可以促进HCT116细胞的生长、迁移和侵袭。由于血清中的EVs也包含肝脏来源的EVs,而脂肪肝又可以产生EVs,因此研究人员猜想脂肪肝产生的EVs是促进转移性肿瘤生长的关键。
为了验证这一猜想,研究人员在原代肝细胞和Huh7细胞系中加入了棕榈酸(PA),在PA刺激下,肝细胞产生了更多的EVs。这些EVs可被结直肠癌细胞(MC38和HCT116细胞)吸收。吸收EVs后,结直肠癌细胞的侵袭性变强了。总之,以上结果提示,脂肪肝来源的EVs会加速肝脏转移性肿瘤的生长。
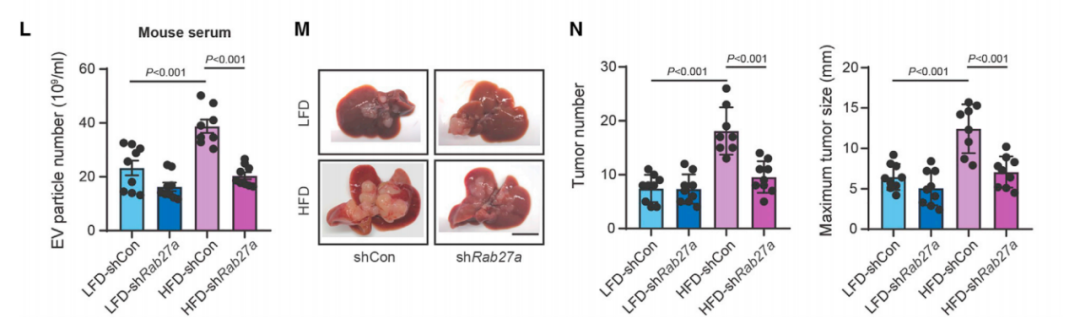
正常情况下,EVs产生受中性鞘磷脂酶和Rab27a/b蛋白调控,在HFD小鼠、PA处理过的肝细胞以及NAFLD患者肝细胞中,研究人员均观察到Rab27a表达上调。
当Rab27a被敲降后,EVs产生减少,HFD小鼠肝脏转移性肿瘤生长被抑制了,相反,Rab27a过表达则会促进结直肠癌的肝转移。因此研究人员认为,脂肪肝促进结直肠癌肝转移是通过上调Rab27a表达,增加EVs的产生实现的。
Rab27a表达对转移性肿瘤大小的影响
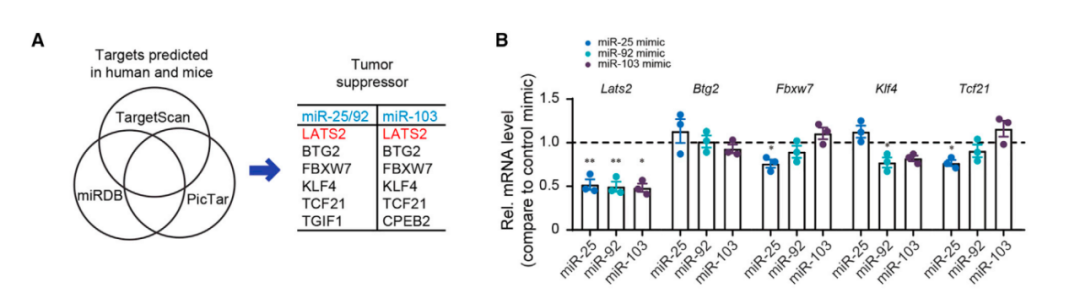
接下来,研究人员分析了EVs的组成,通过miRNA PCR定量分析发现,miR-103、miR-25和miR-92a这三种miRNA在肝脏来源的EVs中表达特别丰富。当研究人员用这三个miRNA处理MC38和HCT116细胞后,这些癌细胞的增殖、迁移和侵袭能力都会增加。
随后,研究人员又寻找了这三个miRNA的直接靶标,利用多种目标基因预测算法,研究人员发现了与这三个miRNA有关的抑癌基因,LATS2。LATS2也是促癌YAP信号的负调控因子,当用这三个miRNAs处理结直肠癌细胞时,LATS2的表达明显降低,而YAP蛋白的表达则明显增加。这一现象在HFD小鼠模型中也得到了证实。
LATS2表达下调
此外,研究人员还发现,敲降Rab27a后,可逆转由于HFD引起的LATS2表达的下降和YAP及YAP靶基因(Ankrd1、Axl1、Ccn2和Ccn1)表达的增加。这些结果表明,EVs可通过抑制LATS2基因的表达来激活YAP这一促癌信号通路。
那YAP信号通路的激活会对结直肠癌的肝转移产生哪些影响呢?
在体外实验中,研究人员发现,YAP信号通路的激活会募集更多的M2型肿瘤相关巨噬细胞,形成了一个免疫抑制的微环境。若敲降Yap1,HFD和LFD小鼠的转移性肿瘤生长都受到了抑制,此外,敲降Yap1也减少了M2型肿瘤相关巨噬细胞的聚集。
既往研究显示,YAP的一个靶基因,Ccn1,编码的一种蛋白CYR61,会促进肿瘤增长。当研究人员沉默Ccn1后,发现脂肪肝中M2型肿瘤相关巨噬细胞的浸润和基因表达都受到了抑制。以上结果表明,YAP信号通路的激活会促进M2巨噬细胞的浸润和CYR61的产生,进一步促进了肿瘤的增长。
研究机制图
最后,研究人员在人类伴有脂肪肝的结直肠癌肝转移患者中也观察到类似机制。总之,该研究验证了脂肪肝中由肝细胞衍生的EVs在结直肠癌肝转移过程中的重要作用,并进一步揭示了其具体分子机制,为日后结直肠癌肝转移的治疗提供了新的思路。
参考文献:
[1]Wang Z, Kim SY, Tu W, Kim J, Xu A, Yang YM, Matsuda M, Reolizo L, Tsuchiya T, Billet S, Gangi A, Noureddin M, Falk BA, Kim S, Fan W, Tighiouart M, You S, Lewis MS, Pandol SJ, Di Vizio D, Merchant A, Posadas EM, Bhowmick NA, Lu SC, Seki E. Extracellular vesicles in fatty liver promote a metastatic tumor microenvironment. Cell Metab. 2023 May 9:S1550-4131(23)00140-7. doi: 10.1016/j.cmet.2023.04.013.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


