Ssu72-HNF4α信号轴对脂肪性肝炎向肝细胞癌转变的分类
来源:本站原创 2021-10-26 10:49
越来越多的证据表明脂肪性肝炎和肝细胞癌之间存在机制联系。然而,缺乏有代表性的动物模型阻碍了理解脂肪性肝炎相关肝癌的病理生理机制的努力。
越来越多的证据表明脂肪性肝炎和肝细胞癌之间存在机制联系。然而,缺乏有代表性的动物模型阻碍了理解脂肪性肝炎相关肝癌的病理生理机制的努力。作者发现小鼠Ssu72磷酸酶的肝脏特异性缺失导致非酒精性脂肪性肝病和非酒精性脂肪性肝炎的高发病率,但不是HCC。
然而,在各种化学和代谢综合征诱导的HCC模型中,Ssu72的缺失显着增加了HCC发展的可能性以及肝祖细胞的群体。重要的是,肝脏Ssu72缺失通过Ssu72介导的肝细胞核因子4α(HNF4α)的去分化诱导成熟的肝细胞向祖细胞转化,HNF4 HNF4是肝细胞功能的主要调节因子。
图片来源:https://doi.org/10.1038/s41418-021-00877-x
大量研究表明,非酒精性脂肪性肝病(Nafld)和非酒精性脂肪性肝炎(Nash)是由肝实质细胞和非实质细胞共同调控的复杂异质性疾病。非酒精性脂肪肝的范围从单纯的无炎症脂肪变性到非酒精性脂肪性肝病。它可能导致纤维化、肝硬化和肝细胞癌(HCC)。肝癌的发生是一个多步骤的过程,在这个过程中,许多遗传和表观遗传突变在肝细胞中积累。它包括正常细胞通过所谓的肿瘤起始细胞(TIC)过渡到癌前病变发展成HCC的阶段。然而,将终末分化的肝细胞转化为抽搐的功能机制却知之甚少。
在慢性肝损伤过程中,肝细胞以前体细胞(啮齿动物又称兼性干细胞和卵圆形细胞)的形式存在于汇管区周围。这些细胞具有双峰电位(双电位)。它们可以增殖和分化为肝细胞和胆管细胞。它们通常形成肝母细胞,肝母细胞由胆管小管和胆管细胞串组成,这一过程称为胆管反应。这些祖细胞隔间的激活与肝癌发生的风险增加有关。相反,在肝癌发展的早期,肝细胞在中心周围区域转化为祖细胞。它们的起源代表了一种转录性签名,类似于位于门静脉周围区域的双潜能FSCs。
在肝部分切除和/或急性肝损伤后的肝再生过程中,增殖反应(也称为代偿性增殖)是维持肝脏质量和损伤修复所必需的。然而,肝细胞不会经历超过几轮的细胞分裂。另一方面,慢性化学或高脂饮食(Hfd)干预会刺激肝细胞去分化(已知有增殖潜力),然后肝细胞经过多次分裂而形成恶性肝细胞癌。在肝癌发展的背景下,几个研究小组已经证明,终末分化的肝细胞可以转化为肝母细胞或胆管细胞样肿瘤,以前认为这些肿瘤完全起源于胆管细胞。
因此,鉴定调节肝细胞致癌去分化的分子信号以及与致癌和转移性去分化相关的非实质生态位可能是理解功能性HCC发展的有希望的策略。然而,尚未清楚地证明参与将完全分化的肝细胞重编程为去分化状态的分子机制。
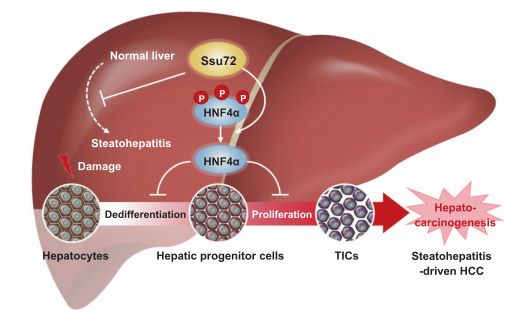
Ssu72介导的转录信号如何通过肝细胞去分化调节脂肪性肝炎向肝癌转化的模型
图片来源:https://doi.org/10.1038/s41418-021-00877-x
Ssu72是新近发现的一种具有双重特异性的磷酸酶,与细胞周期调控和肝脏动态平衡有关。它的耗竭会引起各种肝病,发病率很高。然而,到目前为止,Ssu72磷酸酶的重要性一直被完全忽视,尽管基因中断研究清楚地表明,Ssu72和其他磷酸酶在肝病中没有冗余。本研究通过肝细胞去分化为脂肪性肝炎相关肝癌的发生和发展提供了重要的见解。(生物谷 Bioon.com)
参考文献
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。




