J Hepatol | 空军军医大学陶开山/贾林涛发现肝内胆管癌的发病新机理
来源:生物探索 2024-05-03 10:19
肝内胆管癌(iCCA)是一种罕见的原发性、高度侵袭性的肝脏恶性肿瘤,起源于肝内和肝外胆管上皮细胞。迄今为止,对iCCA进行最佳诊断和管理仍然是一项艰巨的挑战。
空军军医大学陶开山及贾林涛共同通讯在Journal of Hepatology(IF 26)在线发表题为“Nucleolin lactylation contributes to intrahepatic cholangiocarcinoma pathogenesis via RNA splicing regulation of MADD ”的研究论文,该研究表明核蛋白乳酸化通过RNA剪接调控MADD参与肝内胆管癌的发病。核蛋白(Nucleolin, NCL)是核核中最丰富的RNA结合蛋白,被认为是与iCCA发生和发展相关的功能性乳酸化靶点。在糖酵解过度活跃的情况下,NCL主要在赖氨酸477位点被酰基转移酶P300乳酸化,并促进iCCA细胞的增殖和侵袭。
在机制上,乳酸化的NCL结合到MAP激酶激活死亡结构域蛋白(MADD)的初级转录本上,并通过避免产生过早终止密码子的选择性剪接来保证MADD的有效翻译。NCL乳酸化、MADD和随后的ERK激活促进了异种移植物肿瘤的生长,并被发现与iCCA患者的总生存率相关。总之,NCL通过RNA剪接依赖机制乳酸化上调MADD,从而通过MAPK途径增强iCCA的发病机制。

肝内胆管癌(iCCA)是一种罕见的原发性、高度侵袭性的肝脏恶性肿瘤,起源于肝内和肝外胆管上皮细胞。尽管世界范围内的发病率不断上升,但由于缺乏潜在的治疗选择,迄今为止,对iCCA进行最佳诊断和管理仍然是一项艰巨的挑战。
虽然大多数iCCA是新发的,没有可识别的危险因素,但染色体突变已被定位到典型的癌症相关基因座,包括KRAS、TP53、IDH1/2、BAP1、MDM2和FGFR2,这些基因座导致致癌信号的过度活跃,例如MAPK和PI3K/AKT通路。这些遗传改变最终通过CDX2、TTF1、GATA3和PAX8等转录因子的异常激活导致基因的广泛失调。然而,越来越多的研究表明,在iCCA的发展过程中,除基因转录调控外,其他机制也发挥着不可或缺的作用。
特别是,在pre-mRNA成熟过程中的选择性剪接(AS),这是由于产生或破坏剪接位点的突变,剪接因子的异常表达以及影响剪接事件活性的信号通路受损,已经被证实能够微调iCCA的基因表达谱。此外,翻译后修饰,如FGFRs或hnRNP-K的糖基化和BAP1等关键调控因子的泛素化/去泛素化,也被证明是iCCA发病机制的基础,增加了异常基因表达的分层和多级调控的复杂性。
在过去的3年里,人们发现了一种新型的翻译后修饰—蛋白质乳酸化,它参与了各种生理和病理过程。在组蛋白上,赖氨酸残基上添加乳酸基首次被报道,这代表了一种驱动基因转录的新型表观遗传模式。然而,后来发现所谓的赖氨酸乳酸化在非组蛋白中普遍存在。乳酸化最常见的供体是糖酵解的最终产物乳酸盐,因此将其从代谢废物或能量来源重新定义为基因表达和蛋白质功能的关键调节剂。
乳酸化蛋白分布在多个亚细胞区室中,并与多种生物过程密切相关,包括mRNA剪接、糖酵解、氨基酰基- tRNAs生物合成、RNA转运和许多信号通路。因此,蛋白质乳酸化已被确定在炎症、神经发育和肿瘤发展中发挥重要作用。在肿瘤发生的情况下,乳酸化也可能在代谢重编程和复杂的信号网络之间提供直接联系,这些信号网络是基因解除管制和癌症特征的基础。然而,大多数恶性肿瘤的乳酸酶仍有待研究,蛋白质乳酸化在癌症发生和进展中的作用在很大程度上仍然难以捉摸。
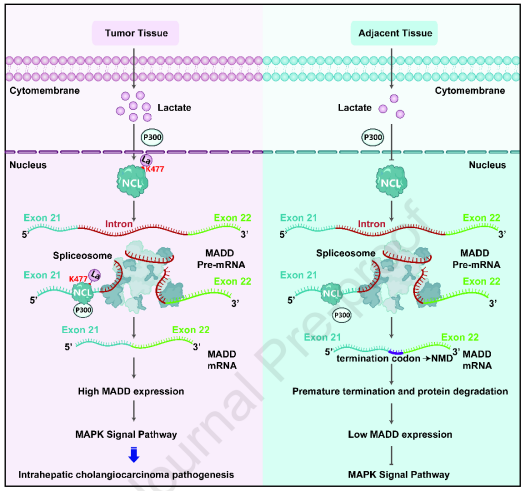
模式图(Credit: Journal of Hepatology)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


