阿尔茨海默病研究重大突破!Cell:发现"通讯杀手"蛋白,胶质细胞与神经元对话崩了
来源:生物谷原创 2025-09-28 11:12
一项由西奈山伊坎医学院领导的新研究,为理解阿尔茨海默病中脑细胞如何相互作用提供了迄今为止最全面的视角。该研究绘制了蛋白质相互作用网络,揭示了细胞间的通讯故障,并指出了新的治疗机会。
一项由西奈山伊坎医学院领衔,联合圣裘德儿童研究医院、明尼苏达大学等机构开展的新研究,为破解阿尔茨海默病(AD)的发病机制提供了迄今为止最全面的细胞互作视角。研究通过绘制大脑蛋白质相互作用网络,精准定位了细胞间的通讯故障核心,还锁定了全新治疗靶点,相关成果在线发表于顶级期刊《细胞》。
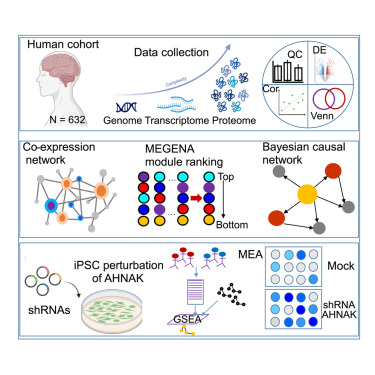
研究团队对来自西奈山/退伍军人医疗中心脑库(MSBB)的 198 例阿尔茨海默病、轻度认知障碍(MCI)及健康对照者的脑组织样本进行了深度分析,重点聚焦于 AD 最易感的脑区——海马旁回(PHG)。这里是记忆形成、视觉场景回忆的关键中枢,其结构异常早已被证实与 AD 患者的认知损害密切相关。通过先进的蛋白质组学技术,团队成功检测到 12147 种独特的蛋白质亚型,它们来自 9272 个不同基因,为构建精细的分子网络奠定了基础。
与以往多聚焦于 β 淀粉样蛋白(Aβ)斑块和 tau 蛋白缠结的研究不同,该团队采用 "无监督" 分析方法,不预设关键蛋白质,而是通过计算模型构建大规模蛋白质共表达网络和贝叶斯因果网络,最终识别出 386 个共表达蛋白质模块和 580 个关键驱动蛋白(KDPs)。其中最核心的发现是:神经元与胶质细胞(尤其是星形胶质细胞和小胶质细胞)之间的通讯中断,是 AD 进展的关键推手,而这一过程被一个名为 AHNAK 的蛋白质主导调控。

"阿尔茨海默病不只是斑块堆积或神经元死亡,本质上是整个大脑生态系统的崩溃," 研究资深作者、西奈山伊坎医学院神经遗传学教授 Bin Zhang 博士指出,"我们的研究明确,神经元和胶质细胞间健康通讯的丧失,可能是疾病恶化的主要原因。" 在健康大脑中,神经元负责信号传递,胶质细胞提供支持保护,两者协同维持大脑稳态。但在 AD 患者脑中,这种平衡被彻底打破:团队发现,多个胶质细胞特异性模块(如 M3、M46)活性异常升高,而神经元特异性模块(如 M2、M5)则显著下调,伴随炎症反应加剧,这种变化在 ROSMAP、BLSA 等多个独立队列及 5xFAD 小鼠模型中均得到验证。
作为排名前五的关键驱动蛋白,AHNAK 的作用尤为突出。这种主要表达于星形胶质细胞的蛋白质,在 AD 患者脑中呈显著上调趋势,且与疾病严重程度密切相关 ——从 APOE33 基因型健康人群,到 APOE33 基因型 AD 患者,再到 APOE4 基因型 AD 患者,AHNAK 的表达水平逐步攀升。更重要的是,AHNAK 是胶质细胞 - 神经元互作模块 M3 的核心枢纽,其网络周边富集了大量与 AD 病理相关的蛋白质。
为验证 AHNAK 的功能,研究团队利用 APOE4/4 基因型 AD 患者的诱导多能干细胞(iPSC)构建星形胶质细胞模型,通过短发夹 RNA(shRNA)敲低 AHNAK 表达。结果显示,AHNAK 水平降低后,星形胶质细胞中的磷酸化 tau(pTau)水平下降近 30%,Aβ₄₂、Aβ₄₀及 APOE 水平也有适度降低。当这些 AHNAK 敲低的星形胶质细胞与 5xFAD 小鼠的原代皮质神经元共培养时,原本活性低下的神经元出现显著改善:放电频率提升 1.8 倍,同步性和爆发活动明显增强,同时神经元中的 pTau 水平也显著降低。这表明,靶向 AHNAK 能有效缓解神经变性损伤。
研究还揭示了 AD 发病的个体差异机制:性别和遗传背景会显著影响蛋白质网络的异常模式。例如,女性 AD 患者中有 784 个上调蛋白、220 个下调蛋白,而男性患者对应为 434 个上调蛋白、142 个下调蛋白,两者存在大量独特的差异蛋白;携带 AD 高风险基因 APOE4 的患者,其蛋白质网络破坏程度远高于 APOE33 基因型患者,且 AHNAK 等关键蛋白的异常表达更为显著。此外,团队还发现 10 个仅存在于海马旁回的特异性蛋白模块,其中神经元模块 M2 参与化学突触传递,其功能异常可能是 AD 记忆损害的专属机制。
"这些结果证实,AHNAK 是极具潜力的治疗靶点," 共同资深作者、明尼苏达大学神经病学教授 Dongming Cai 医学博士表示,"降低其活性能减少毒性蛋白、恢复神经元功能,这为恢复大脑健康提供了明确方向。" 值得关注的是,研究发现的 580 个关键驱动蛋白中,72%(340 个)在 AD 研究中被极少提及,其中 105 个从未被研究过,这为 AD 研究开辟了全新领域。
目前,该研究的所有数据已通过 AD 知识门户向全球研究者公开。尽管 AHNAK 等关键蛋白的体内功能及临床转化仍需进一步验证,但这项研究提供的不仅是一个新靶点,更是一种理解 AD 的全新框架——将疾病视为细胞通讯系统的崩溃,而非单一分子的异常。"通过解析这些 ' 细胞对话 ' 的故障点,我们终于能着手开发让大脑系统重归平衡的治疗方法,"Zhang 博士补充道。(生物谷Bioon.com)
参考文献:
Erming Wang et al, Multiscale Proteomic Modeling Reveals Protein Networks Driving Alzheimer's Disease Pathogenesis, Cell (2025). DOI: 10.1016/j.cell.2025.08.038.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


