MOL CANCER:DLC1如何起到抑癌活性作用?需要其START结构域与磷脂酰丝氨酸、PLCD1和小泡蛋白-1的共同作用!
来源:本站原创 2021-11-14 23:19
近段时间Beatriz Sanchez-Solana教授及其团队针对DLC1基因开展了相关研究,以探索其主要的作用机制。
2021年11月14号 讯/生物谷BIOON/ DLC1是一种肿瘤抑制基因,可通过遗传或非遗传机制在许多癌症类型中下调,其编码的蛋白质RhoGAP和支架活性有助于发挥其肿瘤抑制功能。DLC1 START (star相关脂质转移;DLC1(启动))结构域,除了已被证实的它与Caveolin-1结合外,人们对其知之甚少。在其他的START结构域中,一个关键的功能是它们与脂质的结合,但对于DLC1-START的脂质配体推测目前尚不清楚。

近段时间Beatriz Sanchez-Solana教授及其团队针对DLC1基因开展了相关研究,以探索其主要的作用机制。

研究人员应用脂质覆盖试验和磷脂酰丝氨酸(PS)-下拉试验证实了DLC1-START与PS的结合。共免疫沉淀研究证明了DLC1-START与磷脂酶Cδ1(PLCD1)或小泡蛋白-1之间的相互作用,以及PS对这些相互作用的贡献。采用Rho-GTP、细胞增殖、细胞迁移和/或锚定非依赖性生长分析来研究PS和PLCD1对DLC1功能的贡献以及TCGA癌症相关DLC1-START突变体对DLC1功能的影响。共免疫沉淀和PS下拉分析用于研究DLC1-START突变体功能受损的分子机制。为了更好地理解DLC1-START中癌症相关突变的结构含义,他们还建立了DLC1-START的结构模型。
该研究鉴定出PS(磷脂酰丝氨酸)DLC1-START的脂质配体,并确定DLC1-START除了与小泡蛋白-1结合外,还可与PLCD1蛋白结合。PS结合促进了DLC1与Caveolin-1和PLCD1的相互作用。研究人员对7个肿瘤相关的DLC1-START突变体的分析提示了这些活性在肿瘤发生中的重要性,每个突变体都降低了肿瘤抑制功能,但保留了野生型RhoGAP活性。另外,对DLC1-START的结构模型研究表明,突变体扰乱了结构中的不同元素,这与本实验结果相关联,突变体的结合特性不足,表现为异质性,有些减少了PS(磷脂酰丝氨酸)的结合,有些减少了PLCD1和Caveolin-1的结合,还有一些缺乏上述所有特性。
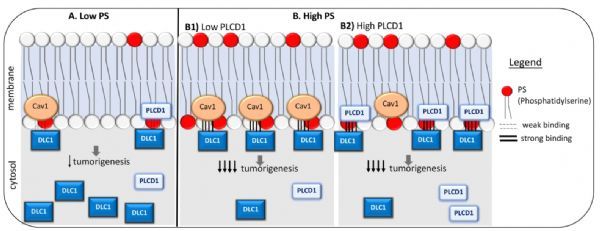
假设的简化图形
总之,目前已经可以确定PS(磷脂酰丝氨酸)是一种可行的生理性DLC1-START相互作用脂质,可能通过将DLC1锚定在膜上并促进其与其他蛋白质(如小泡蛋白-1或PLCD1)的结合,对DLC1的完整活性至关重要。总的来说,DLC1-START、小泡蛋白-1、PLCD1和磷脂酰丝氨酸(PS)之间的相互作用以RhoGAP非依赖性方式促进DLC1肿瘤抑制功能。

近段时间Beatriz Sanchez-Solana教授及其团队针对DLC1基因开展了相关研究,以探索其主要的作用机制。

研究人员应用脂质覆盖试验和磷脂酰丝氨酸(PS)-下拉试验证实了DLC1-START与PS的结合。共免疫沉淀研究证明了DLC1-START与磷脂酶Cδ1(PLCD1)或小泡蛋白-1之间的相互作用,以及PS对这些相互作用的贡献。采用Rho-GTP、细胞增殖、细胞迁移和/或锚定非依赖性生长分析来研究PS和PLCD1对DLC1功能的贡献以及TCGA癌症相关DLC1-START突变体对DLC1功能的影响。共免疫沉淀和PS下拉分析用于研究DLC1-START突变体功能受损的分子机制。为了更好地理解DLC1-START中癌症相关突变的结构含义,他们还建立了DLC1-START的结构模型。
该研究鉴定出PS(磷脂酰丝氨酸)DLC1-START的脂质配体,并确定DLC1-START除了与小泡蛋白-1结合外,还可与PLCD1蛋白结合。PS结合促进了DLC1与Caveolin-1和PLCD1的相互作用。研究人员对7个肿瘤相关的DLC1-START突变体的分析提示了这些活性在肿瘤发生中的重要性,每个突变体都降低了肿瘤抑制功能,但保留了野生型RhoGAP活性。另外,对DLC1-START的结构模型研究表明,突变体扰乱了结构中的不同元素,这与本实验结果相关联,突变体的结合特性不足,表现为异质性,有些减少了PS(磷脂酰丝氨酸)的结合,有些减少了PLCD1和Caveolin-1的结合,还有一些缺乏上述所有特性。

假设的简化图形
总之,目前已经可以确定PS(磷脂酰丝氨酸)是一种可行的生理性DLC1-START相互作用脂质,可能通过将DLC1锚定在膜上并促进其与其他蛋白质(如小泡蛋白-1或PLCD1)的结合,对DLC1的完整活性至关重要。总的来说,DLC1-START、小泡蛋白-1、PLCD1和磷脂酰丝氨酸(PS)之间的相互作用以RhoGAP非依赖性方式促进DLC1肿瘤抑制功能。
原始出处:Sanchez-Solana B, Wang D, et al. The tumor suppressor activity of DLC1 requires the interaction of its START domain with Phosphatidylserine, PLCD1, and Caveolin-1. Mol Cancer. 2021 Nov 2;20(1):141. doi: 10.1186/s12943-021-01439-y. PMID: 34727930; PMCID: PMC8561924.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


