Cell子刊:上海中医药大学栾鑫/张卫东/张莉君团队开发基于铁死亡的乳腺癌治疗新策略
来源:生物世界 2025-01-16 14:33
研究团队发现了一种小分子——CT-1,它是隐丹参酮(CTS)的衍生物,能够有效抑制三阴性乳腺癌(TNBC)的生长,同时显著降低肿瘤组织中 N2 型肿瘤相关中性粒细胞(N2 型 TAN)的比例。
上海中医药大学栾鑫、张卫东、张莉君等人在 Cell 子刊 Cell Reports Medicine 上发表了题为:Dual ferroptosis induction in N2-TANs and TNBC cells via FTH1 targeting: A therapeutic strategy for triple-negative breast cancer 的研究论文。
该研究发现了隐丹参酮(CTS)的一种衍生物小分子——CT-1,通过靶向 FTH1,诱导N2 型肿瘤相关中性粒细胞(N2 型 TAN)和三阴性乳腺癌(TNBC)细胞的双重铁死亡,从而为三阴性乳腺癌(TNBC)的治疗带来了新策略。

中性粒细胞作为具有抗炎功能的关键免疫细胞,在三阴性乳腺癌(TNBC)的发展、转移和预后中发挥重要作用。肿瘤相关中性粒细胞(TAN)与 TNBC 的不良预后密切相关,其可分为两种亚型:抗肿瘤 N1 型、促肿瘤 N2 型。
在 TNBC 的早期阶段,N1 型 TAN 主要通过分泌 I 型干扰素(IFN-α)和通过白细胞介素-18(IL-18)激活自然杀伤(NK)细胞来抑制肿瘤生长。但随着 TNBC 的进展,N2 型 TAN 占比增加。这些 N2 型 TAN 通过释放中性粒细胞弹性蛋白酶(NE)和上调增殖诱导配体(APRIL)促进 TNBC 细胞增殖。此外,它们还通过分泌趋化因子、血管内皮生长因子(VEGF)和基质金属蛋白酶-9(MMP-9)促进肿瘤血管生成。它们与循环肿瘤细胞(CTC)的相互作用也导致中性粒细胞胞外诱捕网(NET)的释放,促进血行转移,增加肺转移的风险。
虽然阻断或消除中性粒细胞浸润肿瘤可在一定程度上抑制 TNBC 的生长和转移,但中性粒细胞是体内最丰富的免疫细胞,完全阻碍其迁移会损害整体免疫防御。因此,对 N2 型 TAN 的精准靶向和选择性清除,成为 TNBC 治疗方案开发中的一个重要焦点。
铁死亡(Ferroptosis)是一种受控的非凋亡细胞死亡新形式,以多不饱和磷脂的过度过氧化为特征,与多种生物学过程密切相关,包括铁代谢、氨基酸代谢、脂质代谢以及谷胱甘肽、还原型烟酰胺腺嘌呤二核苷酸磷酸(NADPH)、磷脂和辅酶Q10的生物合成。在这些过程中,多不饱和脂质含量是铁死亡易感性的关键决定因素。
最近的单细胞转录组和全转录组分析揭示了 TAN 中参与铁死亡调控的基因的富集和上调。脂质积累在乳腺癌肿瘤组织中的 N2 型 TAN 中更为明显,这些储存的脂质被转移到肿瘤细胞,为其生长和转移提供燃料。这提示了我们,N2 型 TAN 可能特别容易发生铁死亡。
TNBC 还表现出与铁死亡相关的异常基因表达模式,包括铁代谢相关的转铁蛋白受体和脂代谢相关的 ACSL4 表达上调,以及铁输出转运蛋白的表达下调。这些失调的基因表达,特别是在铁和脂质代谢方面,为TNBC提供了大量的铁和脂质,使癌细胞特别容易受到铁死亡诱导药物的影响。
因此,确定一个能够同时诱导 N2 型 TAN 和 TNBC 细胞发生铁死亡的精准靶点,具有重要的治疗意义。
在这项最新研究中,研究团队发现了一种小分子——CT-1,它是隐丹参酮(CTS)的衍生物,能够有效抑制三阴性乳腺癌(TNBC)的生长,同时显著降低肿瘤组织中 N2 型肿瘤相关中性粒细胞(N2 型 TAN)的比例。
此外,CT-1 在体外和体内均能诱导 N2 型 TAN 和 TNBC 细胞同时发生铁蛋白自噬诱导的铁死亡,其作用机制是通过靶向铁蛋白重链-1(FTH1)并促进 NCOA4 与铁蛋白的相互作用来实现的。
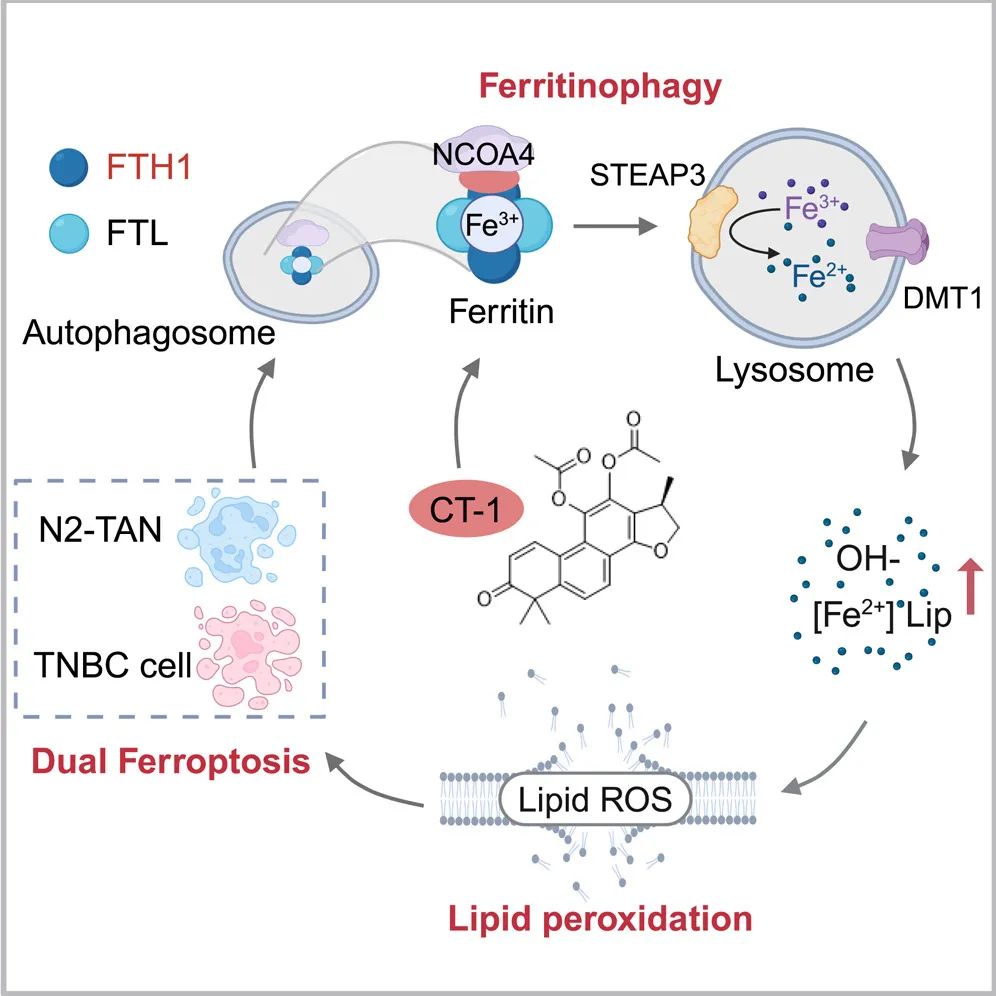
这些发现表明,CT-1 作为一种有前景的治疗剂,能够诱导 N2 型肿瘤相关中性粒细胞(N2 型 TAN)和三阴性乳腺癌(TNBC)细胞发生铁死亡,为通过靶向 FTH1 治疗三阴性乳腺癌提供了新策略。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


