Science:抗磷脂综合征研究取得重大突破!阻断EPCR-LBPA结合有望治疗这种疾病
来源:本站原创 2021-03-17 06:52
2021年3月17日讯/生物谷BIOON/---在一项新的研究中。来自德国和美国多个研究机构的研究人员发现了导致抗磷脂综合征(antiphospholipid syndrome, APS)的磷脂靶向自身抗体(即靶向磷脂的自身抗体,下称aPL)的一个细胞表面靶标。相关研究结果发表在2021年3月12日的Science期刊上,论文标题为“Lipid presen
2021年3月17日讯/生物谷BIOON/---在一项新的研究中。来自德国和美国多个研究机构的研究人员发现了导致抗磷脂综合征(antiphospholipid syndrome, APS)的磷脂靶向自身抗体(即靶向磷脂的自身抗体,下称aPL)的一个细胞表面靶标。相关研究结果发表在2021年3月12日的Science期刊上,论文标题为“Lipid presentation by the protein C receptor links coagulation with autoimmunity”。在这篇论文中,他们介绍了他们如何利用具有aPL诱导的胎儿丢失和血栓形成的APS小鼠模型来研究导致APS的因素之间的联系。
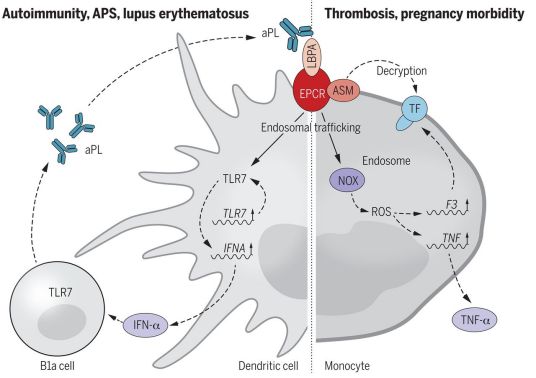
aPL对EPCR-LBPA的识别可促进自身免疫。图片来自Science, 2021, doi:10.1126/science.abc0956。
APS是一种自身免疫性疾病,会使患者患各种疾病的风险增加,从血栓形成到产科并发症。它往往发生在经历狼疮等自身免疫性疾病的患者身上。此前的研究已经发现了可用于识别患者APS的标志物,但仍不知道为什么会出现这种情况。其中一种这样的标志物是aPL的存在增加。不幸的是,在确定这种水平增加的根本原因时也存在一个问题---其他情况也会导致它们的上升,例如传染病。在这项新的研究中,这些作者只关注了水平升高与APS相关的情形。在这样做的时候,他们在APS小鼠模型中发现了蛋白C受体的脂质呈现将凝血与自身免疫联系起来。
通过研究内皮蛋白C受体(EPCR)及其与溶血双磷脂酸(LBPA)的作用方式,这些作者能够鉴定aPL的细胞表面靶标,并观察到aPL在细胞内部如何受到调节。更具体地说,他们发现EPCR作为aPL的细胞表面受体。他们还发现,在某些情况下,EPCR介导了aPL的细胞内化。他们发现aPL与EPCR-LBPA的结合导致凝血激活和树突细胞中的干扰素-α产生。这就导致了更多B1a细胞的产生,而B1a细胞正是aPL的生产者。他们发现,在小鼠模型中阻断EPCR-LBPA的结合,阻止了这一连串事件的开展,从而导致aPL水平的降低。他们认为,这为APS患者开发治疗方法的可能性打开了大门。(生物谷 Bioon.com)
参考资料:
1.Nadine Müller-Calleja et al. Lipid presentation by the protein C receptor links coagulation with autoimmunity. Science, 2021, doi:10.1126/science.abc0956.
2.Mariana J. Kaplan. Linking clotting and autoimmunity. Science, 2021, doi:10.1126/science.abg6449.
3.Antiphospholipid syndrome breakthrough: Cell-surface targets identified, opening path to therapies
https://medicalxpress.com/news/2021-03-antiphospholipid-syndrome-breakthrough-cell-surface-path.html
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


