师从颜宁,获施一公点赞!90后吴建平解析精子阳离子通道复合物三维结构
来源:生物谷 2021-07-12 15:13
受精是精子和卵子的结合,是孕育新生命的基本的生物学过程。精子阳离子通道(CatSper)是精子运动和生育所必需的。受精过程中的几个关键步骤,包括精子超激活、顶体反应和精卵融合,都受到Ca2+信号的调节。精子特异的阳离子通道CatSper主要定位于成熟精子鞭毛的主体部分,负责受精过程中多种依赖Ca2+的生理反应。CatSper介导的Ca2+信号启动酪氨酸磷酸化
受精是精子和卵子的结合,是孕育新生命的基本的生物学过程。精子阳离子通道(CatSper)是精子运动和生育所必需的。受精过程中的几个关键步骤,包括精子超激活、顶体反应和精卵融合,都受到Ca2+信号的调节。
精子特异的阳离子通道CatSper主要定位于成熟精子鞭毛的主体部分,负责受精过程中多种依赖Ca2+的生理反应。CatSper介导的Ca2+信号启动酪氨酸磷酸化级联反应,控制精子的动力。CatSper还在精子趋化性中发挥核心作用。精子的阳离子通道CatSper自发现以来就成为了治疗男性不孕不育以及开发新型避孕药的重要靶点。
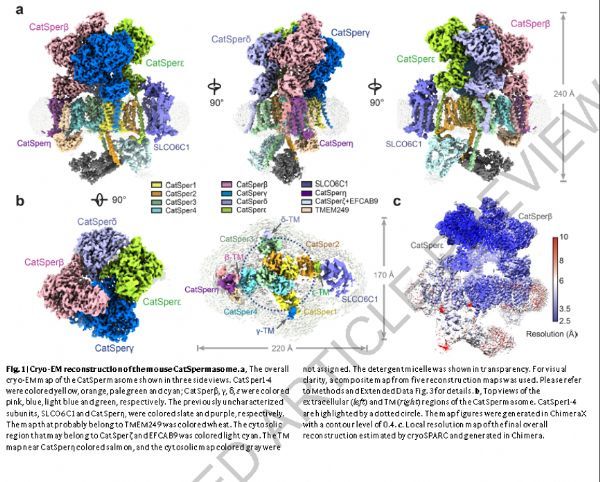
2021 年 7 月 5 日,西湖大学生科院吴建平团队在国际顶尖学术期刊 Nature 发表了题为:Structure of a mammalian sperm cation channel complex 的研究论文。该研究在全世界首次解析了哺乳动物精子阳离子通道复合物 CatSper 的高分辨率三维结构,鉴定出了该复合物的多个全新组分,并将其定义为:CatSpermasome(CatSper通道体)。
图片来源:Nature官网
CatSper在所有已知离子通道中拥有最多亚基。CatSper的突变会削弱男性的生育能力。在小鼠中,CatSper1、2、3或4的缺失会导致精子活力异常,并由于精子过度激活而导致男性不育。CatSper被认为是治疗男性不育的潜在靶点。相反,它也是开发非激素避孕药的一个有吸引力的目标。
通过在CatSper1的N端插入3×FLAG-GFP标签获得转基因(KI)小鼠。在KI小鼠的精子主体中检测到GFP荧光,但在野生型(WT)小鼠中没有检测到GFP荧光。CatSper是从成熟雄性KI小鼠的睾丸和附睾组织中提纯出来的,用于冷冻-EM分析。质谱(MS)分析证实了CatSper组分的存在。
图片来源:Nature. 2021 Jul 5. doi: 10.1038/s41586-021-03742-6. Online ahead of print.
CatSper1-4构成的中央通道域采用规范的VGIC架构。每个辅助亚单位CatSperβ、γ、δ、ε中的单个C端TM螺旋分别连接到CatSper4、1、3、2的相邻电压感应结构域(VSD),庞大的胞外结构域覆盖整个通道结构域。
另一方面,有三个TM成分与CatSperβ和CatSper4相邻:CatSperη,一种可能是TMEM249的蛋白质,和一个具有TM螺旋的非特征成分。胞质区域由两个独立但相互作用的部分组成。一个由特征α螺旋组成的实体可能属于CatSperζ和EFCAB9的亚复合体,因为EFCAB9的两个含EF的叶可以很好地拟合到图中。
图片来源:Nature. 2021 Jul 5. doi: 10.1038/s41586-021-03742-6. Online ahead of print.
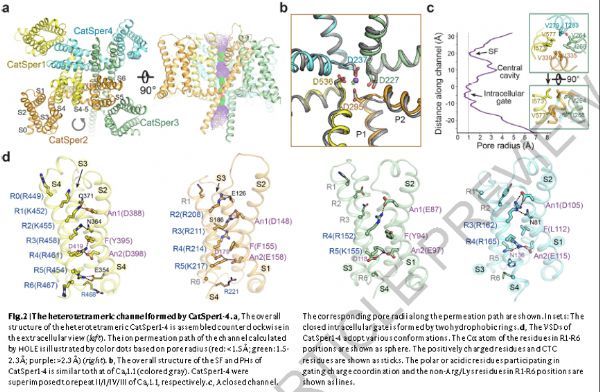
CatSper1-4,每个亚基的S1-S4形成VSD,S5-S6包围离子传导孔,在细胞外视图中逆时针排列,孔结构域(PD)和VSD从相邻的原体进行常规结构域交换。与Cav/Nav通道类似,选择性过滤器(SF)由双孔螺旋(PH),P1和P2支撑,但连接S5和P1(L5)以及P2和S6(L6)的细胞外环明显较短并且缺乏任何糖基化修饰。属于阳离子的密度在SF的前庭中是可辨别的。沿着离子渗透路径,SF和细胞内门代表两个收缩位点。半径小于1的细胞内门被来自S6区段的两层疏水残基密封。因此,当前结构代表闭合通道。
CatSper1-4(VSD1-4)的VSD的序列比对表明它们具有电压敏感性的保守元件,包括S4区段上带正电荷的残基Arg/Lys,电荷转移中心(CTC)和保守的酸性残基。尽管Cav通道(R1-R6)的S4上通常存在4-6个带正电荷的残基,但CatSper1-4的S4上带正电荷的残基数量差异很大,CatSper1中有7个(R0-R6),4个(R2-R5)在CatSper2中,并且在CatSper3(R4-R5)和CatSper4(R3-R4)中仅各自两个。四个VSD表现出不同的构象。当四个VSD相对于CTC和An1叠加时,S4区段变化并且相应GC残基的Cα原子的高度是CatSper3>CatSper2>CatSper4>CatSper1。
图片来源:Nature. 2021 Jul 5. doi: 10.1038/s41586-021-03742-6. Online ahead of print.
CatSperβ,γ,δ,ε中的所有细胞外区段都含有多个模块化结构域。CatSperδ缺少在其他三个亚基中保守的N末端结构域(NTD)。在NTD之后,所有四个亚基由TM螺旋之前的七个β螺旋结构域,Ig样结构域和茎结构域组成。CatSperβ包含一个额外的头部结构域,CatSperε具有一个额外的NTD2结构域。所有这些细胞外结构域(ECD)主要由β链组成,并用多个糖基化位点和二硫键修饰。茎结构域之间缺乏相互作用会留下四个侧开口,这些侧开口允许离子自由通过通道域的SF。CatSperδ和CatSperγ的茎结构域有助于通道亚基和辅助亚基之间的特异性结合。
本篇文章所示的结构为CatSper的门控机制提供了启示。SLCO6C1可能介导类固醇激素(如脱氢表雄酮)的转运,底物通过SLCO6C1的转运可能是通过交替进入机制介导的,该机制可以耦合到CatSper的开口。尽管已经报道了功能性通道转运蛋白复合物,但结构观察仅限于KATP,即钾通道Kir6.2和ABC转运蛋白模块SUR140之间的复合物,但是,SUR1仅充当KATP的ADP传感器。
CatSpermasome中的SLCO6C1是否作为传感器发挥调节作用或通过独特的偶联机制起作用仍有待进一步研究。总之,该结构揭示了CatSpermasome的独特整体组装。SLCO6C1,CatSperη,TMEM249的生理和病理重要性的未来表征以及CatSpermasome的未分配组分的鉴定将有助于对精子生育力的机制理解。
对于这项成果,著名结构生物学家、西湖大学校长施一公评价说:“这是一个充分彰显结构生物学魅力的突破性进展。人类第一次看到了 CatSper 这样一个在哺乳动物受精过程中起到关键作用的钙离子通道复合物的全貌,更重要的是发现了新的蛋白组分,提出了 Catspermasome 的概念,必将极大促进对其功能的研究。”(生物谷 bioon)
参考文献:1. Lin S, Ke M, Zhang Y, Yan Z, Wu J. Structure of a mammalian sperm cation channel complex. Nature. 2021 Jul 5. doi: 10.1038/s41586-021-03742-6. Epub ahead of print. PMID: 34225353.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->