Nature子刊:端粒氧化损伤可以触发细胞衰老
来源:网络 2022-07-11 10:08
衰老细胞随着年龄的增长而累积,是与年龄有关的疾病的关键驱动因素,如癌症、痴呆症和心血管疾病。
衰老细胞随着年龄的增长而累积,是与年龄有关的疾病的关键驱动因素,如癌症、痴呆症和心血管疾病。
在一项新的研究中,来自匹兹堡大学和UPMC希尔曼癌症中心的研究人员发现了一种衰老细胞(也称为僵尸细胞)的产生机制。他们首次报告端粒--染色体的保护性末端,就像鞋带末端的塑料帽--的氧化损伤可以触发细胞衰老。这些发现最终可能指向促进健康衰老或对抗癌症的新疗法。
相关研究结果于2022年6月30日在线发表在Nature Structural & Molecular Biology期刊上,论文标题为“Telomeric 8-oxo-guanine drives rapid premature senescence in the absence of telomere shortening”。

论文通讯作者、匹兹堡大学环境与职业健康教授以及药理学与化学生物学教授Patricia Opresko博士说,“僵尸细胞仍然活着,但它们不能分裂,所以它们不能帮助补充组织。虽然‘僵尸细胞’不能正常发挥作用,但它们不是‘沙发土豆’--它们积极分泌化学物质,促进炎症和损害邻近的细胞。我们的研究有助于回答两个大问题:衰老细胞如何随着年龄的增长而积累,以及端粒又如何促成这一过程?”
当一个健康的人体细胞分裂形成两个相同的子细胞时,每条染色体的末端都被去掉一小块DNA,因此端粒随着每次分裂而逐渐变短。然而,目前仍不清楚在人的一生中,细胞是否会频繁分裂,导致它的端粒完全被侵蚀,从而转变为僵尸样状态。几十年来,科学家们已知端粒缩短会在实验室生长的细胞中引发衰老,但他们只能假设端粒的DNA损伤会使细胞进入僵尸状态。
在此之前,测试这一假设是不可能的,因为用于导致DNA损伤的工具是非特异性的,会造成整个染色体的病变。论文第一作者、Opresko实验室博士后研究员Ryan Barnes博士解释说,“我们的新工具就像一个分子狙击手。它专门在端粒上产生氧化损伤。”
为了实现这种神枪手般的精确性,这些作者使用了一种专门与端粒结合的特殊蛋白。这种蛋白的作用就像捕手的手套,结合他们扔进细胞的“垒球”:光敏染料。当被光激活时,该光敏染料产生破坏DNA的活性氧分子。由于捕捉这种光敏染料的蛋白只与端粒结合,该方法仅在染色体末端产生DNA损伤。
这些作者使用在培养皿中培养的人类细胞,发现端粒的损伤仅在四天后就使这些细胞进入僵尸状态---比在实验室中通过端粒缩短诱导衰老所需的数周或数月时间的反复细胞分裂快得多。
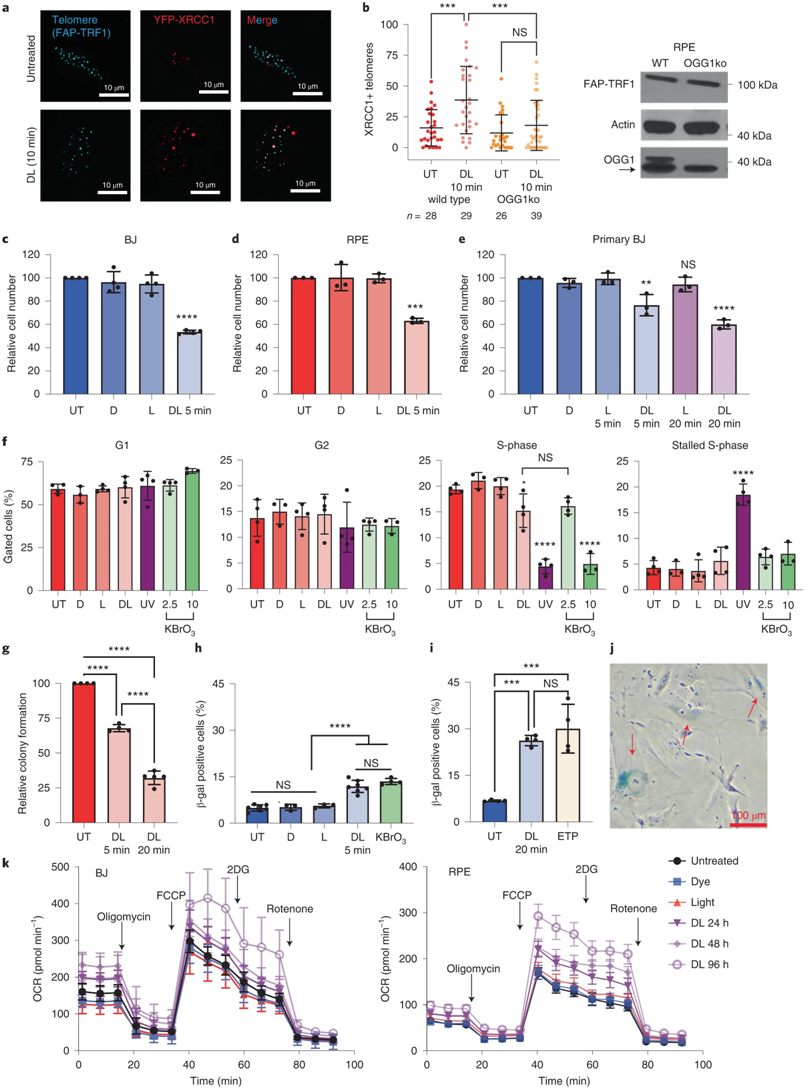
急性端粒8oxoG引发快速过早衰老,图片来自Nature Structural & Molecular Biology, 2022, doi:10.1038/s41594-022-00790-y。
Opresko解释说,“我们发现了一种诱导衰老细胞的新机制,它完全依赖于端粒。这些发现也解决了为什么功能失调的端粒并不总是比功能正常的端粒短的难题。”
阳光、酒精、吸烟、不良饮食和其他因素产生的活性氧分子会损害DNA。细胞有修复途径来修补DNA病变,但是,根据Opresko的说法,端粒对氧化损伤“非常敏感”。这些作者发现,端粒损伤破坏了DNA的复制,并诱发了导致衰老的应激信号通路。
Barnes说,“现在我们了解了这一机制,我们可以开始测试干预措施以防止衰老。例如,也许有办法让抗氧化剂靶向端粒,以保护它们免受氧化损伤。”
这些发现也可以为开发新的药物提供参考,这些药物被称为senolytics(衰老细胞裂解药物),它们可以靶向僵尸细胞并杀死它们。他补充说,“通过减少导致退行性疾病的僵尸细胞的积累,我们也许能够提高‘健康寿命(healthspan)’,即一个人保持健康的时间长度。”
参考资料:
Ryan P. Barnes et al. Telomeric 8-oxo-guanine drives rapid premature senescence in the absence of telomere shortening. Nature Structural & Molecular Biology, 2022, doi:10.1038/s41594-022-00790-y.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


