浙大校友一作Nature论文:揭开癌细胞抵抗铁死亡的关键机制
来源:生物探索 2025-06-13 10:10
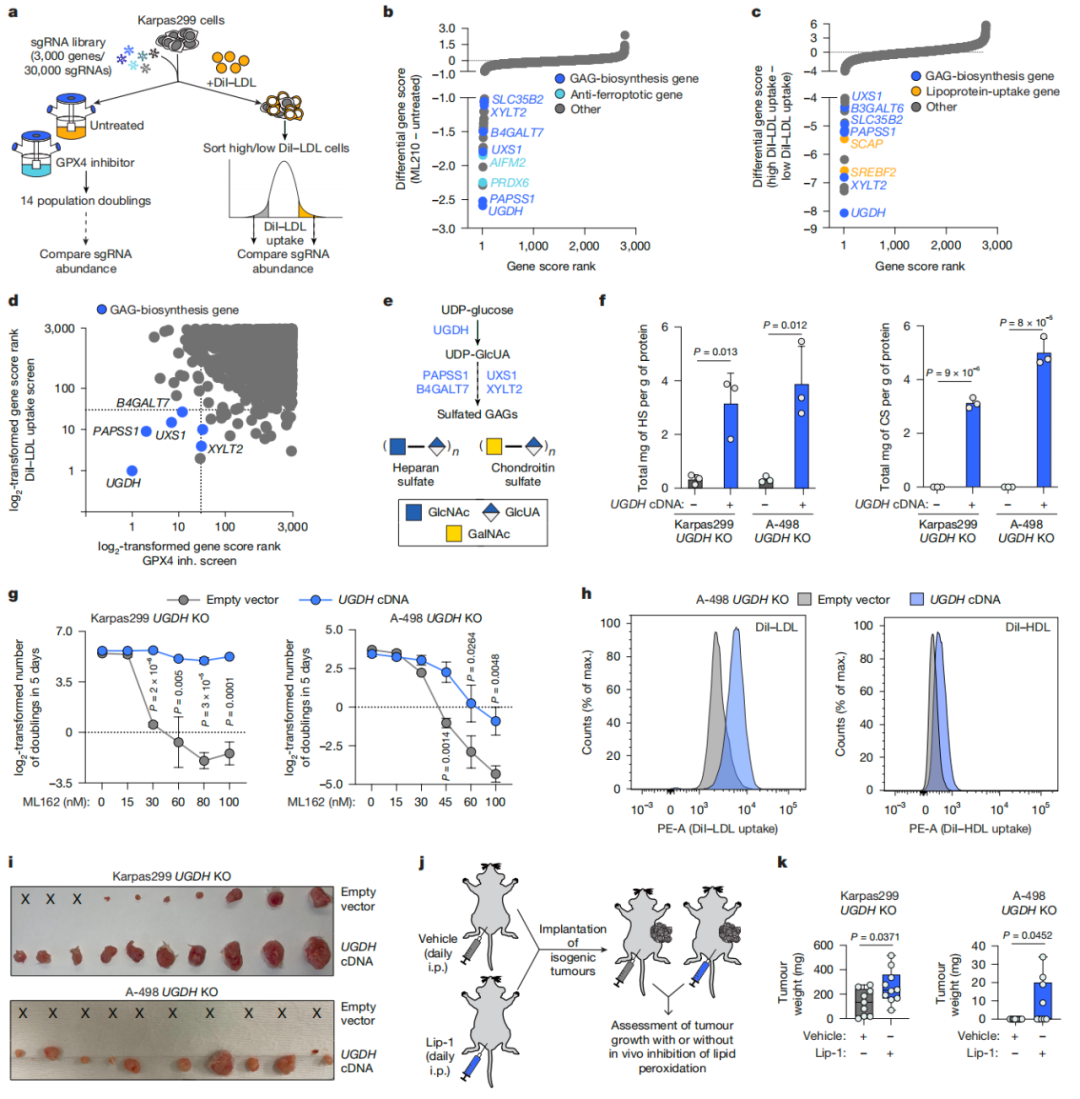
该研究发现并证实,糖胺聚糖驱动的脂蛋白摄取是癌细胞抵抗铁死亡的关键机制,干扰糖胺聚糖的生物合成或急性降解细胞表面的糖胺聚糖,会降低对脂蛋白的摄取,使癌细胞对铁死亡更敏感。
铁死亡(Ferroptosis)是 2012 年由哥伦比亚大学 Brent Stockwell 实验室发现的一种铁依赖性的新型细胞程序性死亡方式,由过度堆积的过氧化脂质(peroxidized lipids)诱导发生,其形态特征,作用方式以及分子机制与其他程序性死亡方式截然不同。同时,细胞中存在多个对抗铁死亡的防御途径,例如谷胱甘肽过氧化物酶4(GPX4)通过谷胱甘肽(GSH)特异性催化过氧化脂质来抑制铁死亡的发生;FSP1 通过产生辅酶 Q10(CoQ10)的抗氧化形式促进癌细胞对铁死亡的抵抗。
近年来的研究表明,铁死亡在肿瘤等多种疾病发生发展中扮演着重要角色。此外,免疫治疗或放射治疗可诱导肿瘤细胞铁死亡,且铁死亡在肿瘤免疫治疗及放疗的疗效发挥中起着重要的促进作用。因此,进一步揭示肿瘤抵抗铁死亡的机制,有助于拓展当前的癌症治疗方向。
2025 年 6 月 11 日,德克萨斯大学西南医学中心 Javier Garcia-Bermudez 团队(Dylan Calhoon、桑凌杰为共同第一作者)在国际顶尖学术期刊 Nature 发表了题为:Glycosaminoglycan-driven lipoprotein uptake protects tumours from ferroptosis 的研究论文。
该研究发现并证实,糖胺聚糖驱动的脂蛋白摄取是癌细胞抵抗铁死亡的关键机制,干扰糖胺聚糖的生物合成或急性降解细胞表面的糖胺聚糖,会降低对脂蛋白的摄取,使癌细胞对铁死亡更敏感,并抑制小鼠体内的肿瘤生长,表明了糖胺聚糖生物合成是一个癌症治疗的潜在新靶点。


桑凌杰,2017年本科毕业于浙江大学,2022 年博士毕业于浙江大学,现为德克萨斯大学西南医学中心博士后。
脂质因其结构功能和信号转导作用而成为癌细胞的重要组成部分。为了满足代谢需求,癌细胞会摄取细胞外脂质,然而,这些脂质如何促进癌症生长和进展,目前仍知之甚少。
在这项最新研究中,研究团队通过功能基因筛选,发现脂蛋白的摄取(循环系统中脂质运输的主要机制)是癌细胞铁死亡敏感性的关键决定因素。补充脂蛋白可有效抑制多种癌症类型的铁死亡,主要是通过递送 α-生育酚(α-toc)来实现的,α-生育酚是人类脂蛋白中最丰富的维生素E形式。
从机制上来说,癌细胞通过一种依赖于与细胞表面蛋白聚糖相连的硫酸化糖胺聚糖(GAG)的途径摄取脂蛋白。干扰糖胺聚糖的生物合成或急性降解细胞表面的糖胺聚糖,会降低对脂蛋白的摄取,使癌细胞对铁死亡更敏感,并抑制小鼠体内的肿瘤生长。
癌细胞需要 GAG 生物合成来摄取脂蛋白,从而抵抗铁死亡、促进肿瘤生长
值得注意的是,研究团队进一步证实,人类肾透明细胞癌(ccRCC,肾癌的最常见亚型,是一种富含脂质的恶性肿瘤)与正常肾组织相比,硫酸软骨素(属于糖胺聚糖)水平升高,且脂蛋白来源的 α-生育酚含量增加。
这些发现共同证实了脂蛋白摄取是癌症中一种关键的抗铁死亡机制,并表明糖胺聚糖生物合成是一个癌症治疗的潜在新靶点。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


