LNP递送mRNA在体内生成CAR-T,新锐公司再获1.75亿美元融资,推进自身免疫病CAR-T临床研究
来源:生物世界 2024-03-25 09:45
一些临床研究显示,CAR-T细胞疗法对系统性红斑狼疮患者产生了良好的治疗效果,这为系统性红斑狼疮患者带来了一种全新的,且安全有效的治疗选择。
2022年9月,辉瑞(Pfizer)、拜耳(Bayer)、诺华(Novartis)、礼来(Eli Lilly)和百时美施贵宝(BMS)这五大制药巨头的风险投资部门向一家生物技术初创公司——Capstan Therapeutics,投资了1.65亿美元(包括6300万美元种子轮融资和1.02亿美元A轮融资)。
2024年3月20日,该公司宣布,完成1.75亿美元的B轮融资,此轮融资由RA Capital领投,原有投资者继续跟投,并增加了强生、Forbion、Mubadala Capital、Perceptive Advisors、Sofinnova Investments等新投资者。
此次融资将用于支持Capstan公司领先的体内原位CAR-T细胞疗法——CPTX2309,以进行自身免疫疾病的早期临床概念验证,并进一步开发其基于靶向脂质纳米颗粒技术(tLNP)的研发管线。
据悉,CPTX2309基于Capstan公司的tLNP技术,将编码抗CD19 CAR的mRNA有效载荷特异性递送到表达CD8的T细胞,有效地在体内原位构建CAR-T细胞,进而在血液和淋巴组织中快速清除B细胞来重置免疫系统,而无需应对传统体外CAR-T细胞疗法面临的挑战。Capstan公司尚未公布该疗法用于治疗哪种或哪些自身免疫疾病。

在生物技术领域融资受挫的大环境下,这家初创公司何以具有如此大魅力?
我们来看关键词:LNP、mRNA、体内原位CAR-T,创始团队包括 Carl June(CAR-T细胞治疗先驱),Drew Weissman(诺奖得主、mRNA技术奠基人),Jonathan Epstein(体内原位CAR-T技术发明人)。

从左至右依次为 Carl June、Drew Weissman、Jonathan Epstein
靶向脂质纳米颗粒技术——tLNP
Capstan公司专有的靶向脂质纳米颗粒技术(tLNP)由三个相互关联的部分组成——非病毒递送系统、细胞特异性靶向分子和针对疾病设计的有效载荷。
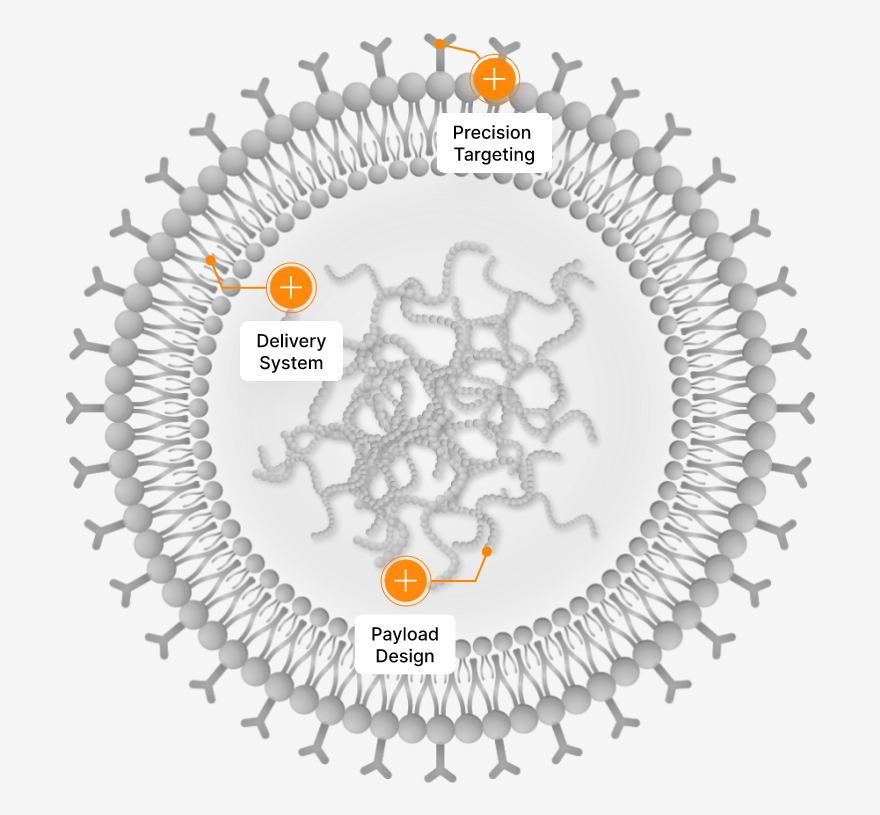
非病毒递送系统:基于脂质纳米颗粒(LNP)的递送系统具有安全、可重复体内给药的潜力,以解锁新的临床应用。
细胞特异性靶向分子:将抗体或抗体片段功能化连接到纳米颗粒表面,产生靶向脂质纳米颗粒(tLNP),以精确递送有效载荷。
针对疾病设计的有效载荷:用mRNA编码嵌合抗原受体(CAR)、基因编辑系统,以及其他治疗性蛋白质。
利用靶向LNP(tLNP)和mRNA技术,开发的体内原位CAR疗法,分别靶向两类细胞——T细胞和造血干细胞,靶向前者,用于治疗血液类癌症、实体瘤,以及纤维化疾病和自身免疫病。靶向后者,用于治疗遗传性血液类疾病。
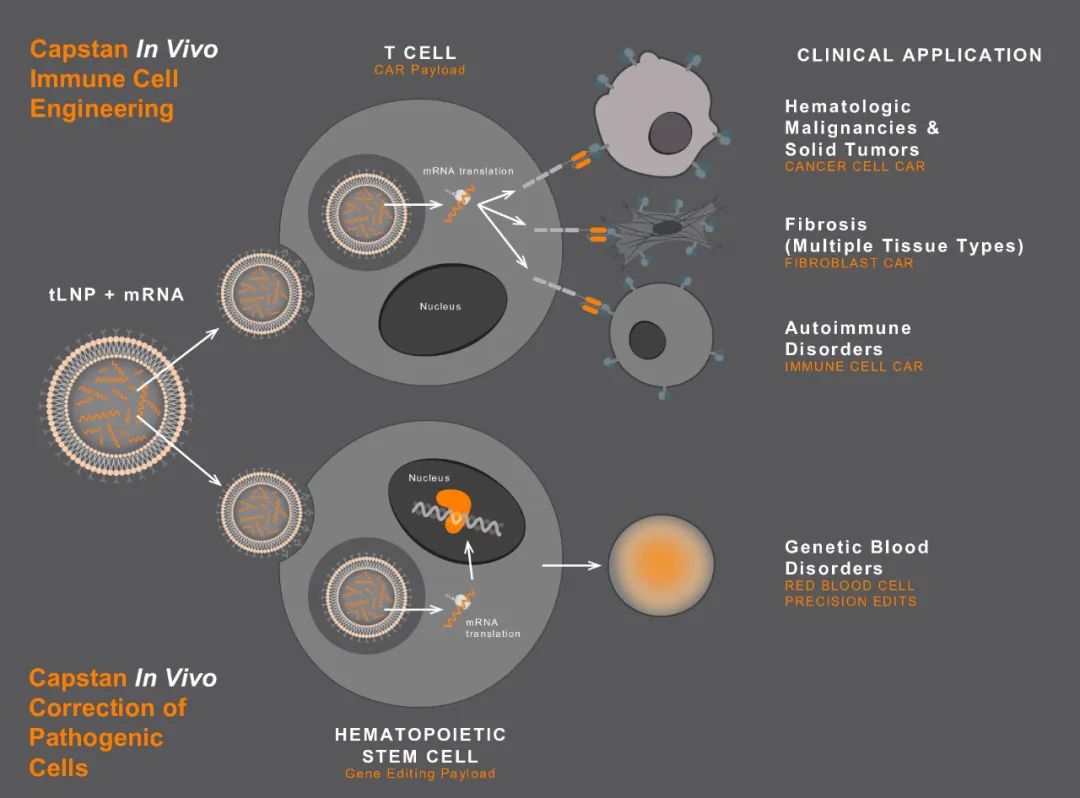
LNP-mRNA,创建体内原位CAR-T
该公司的创立,主要基于创始团队2022年初发表在 Science 的一篇重磅研究论文:CAR-T cells produced in vivo to treat cardiac injury(体内产生的CAR-T细胞治疗心脏损伤)。
研究团队开发了一种在体内生成的瞬时工程化CAR-T细胞疗法,通过注射脂质纳米颗粒(LNP)递送mRNA,重编程T细胞,使其识别心脏纤维化细胞,进而减少纤维化,恢复心力衰竭小鼠模型的心脏功能。
该方法类似于mRNA疫苗,仅需一次注射,就能在体内生成CAR-T细胞疗法,有望解决目前CAR-T疗法工艺复杂、周期长、价格高昂的难题。

在这项新研究中,研究团队设计了一种基于mRNA技术的新型CAR-T细胞疗法,通过mRNA重编程T细胞受体,使其靶向成纤维细胞活化蛋白(FAP),使用脂质纳米颗粒(LNP)进行递送,LNP载体已经在新冠mRNA疫苗中得到了广泛应用和验证。而该LNP载体能够识别T细胞表面高表达的CD5 ,从而特异性靶向T细胞,生成FAP-CAR-T细胞。
在心脏损伤小鼠模型上进行的治疗实验显示,CD5/LNP封装mRNA后注射到小鼠体内,这些mRNA分子成功进入小鼠T细胞中并有效重编程了T细胞,并使其靶向攻击活化的成纤维细胞。这种重编程的暂时性的,mRNA并未整合到T细胞基因组中,几天之后,这些T细胞就恢复如初,不再靶向成纤维细胞。就在这短短几天时间里,mRNA诱导重编程了大量的CAR-T细胞,导致心脏纤维化显著减少,恢复了心脏的正常大小和功能。
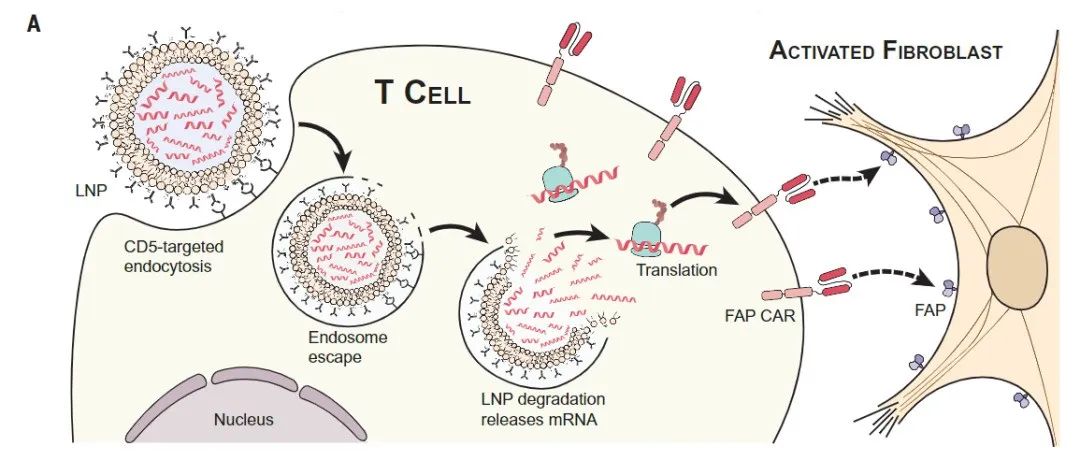
该研究开发的这种在体内生成的瞬时工程化CAR-T细胞疗法,通过具有靶向性的LNP递送mRNA在体内生成CAR-T细胞 ,极大地扩展了CAR-T和mRNA技术的应用前景,而且,这种方法更可控,在流程上也更简单,有望大幅降低CAR-T细胞疗法的成本和价格。
近年来,一些临床研究显示,CAR-T细胞疗法对系统性红斑狼疮患者产生了良好的治疗效果,这为系统性红斑狼疮患者带来了一种全新的,且安全有效的治疗选择。
治愈自身免疫疾病的曙光——CAR-T
2024年2月,《新英格兰医学杂志》(NEJM)上发表了一篇题为:CD19 CAR T-Cell Therapy in Autoimmune Disease — A Case Series with Follow-up 的研究论文。
该论文报道了15名自身免疫病患者(8名系统性红斑狼疮患者、4名系统性硬化症患者和3名特发性炎性肌病患者)在接受CAR-T细胞疗法后重获新生,他们不再出现症状或不再需要进行新的治疗,其中第一批接受治疗的患者已经保持了两年多无病状态。这一结果让人们燃起了彻底治愈自身免疫病的希望。

CAR-T细胞疗法先驱 Carl June 教授曾在 Cell 期刊发表评论文章指出,还需要更大规模的研究和更长期的随访来证实CAR-T细胞治疗红斑狼疮的效果,但从已公布的结果显示出很大的希望。事实上,这些研究表明了红斑狼疮可能比B细胞肿瘤更容易成为CAR-T细胞治疗的靶点。此外,红斑狼疮中的驱动疾病的B细胞数量要比B细胞肿瘤中的少得多,因此,CAR-T细胞治疗红斑狼疮这些自身免疫疾病可能只需要更低的剂量,这将大大减少CAR-T细胞治疗的免疫副作用问题。
值得一提的是,2024年3月21日,Capstan公司的研究人员在《美国国家科学院院刊》(PNAS)发表了一篇题为:IL7 increases targeted lipid nanoparticle–mediated mRNA expression in T cells in vitro and in vivo by enhancing T cell protein translation 的研究论文。
该研究显示,白细胞介素7(IL7)能够选择性地增强向T细胞中递送的mRNAd的蛋白质翻译水平,这一特性可用于在体内提高tLNP递送的mRNA的表达。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


