Nature子刊:赵英明/张迪团队等开发区分蛋白质乳酰化修饰同分异构体的新方法
来源:生物世界 2024-07-21 12:09
该研究不仅开发了一套区分蛋白质翻译后修饰(PTM)异构体的创新方法,而且揭示了KL-la作为细胞对糖酵解和Warburg效应的主要响应者的关键角色。
赖氨酸乳酰化修饰,自2019年首次被报道之后,便因其在调控多种生理和病理过程中的潜在作用而受到广泛关注。这一翻译后修饰不仅为乳酸的非代谢功能研究开辟了新的视角,而且提供了一种新的蛋白质调控机制。赖氨酸乳酰化修饰有三种同分异构体:L-乳酰化(KL-la)、D-乳酰化(KD-la)以及羧乙基化(Kce)。这三种修饰都可能由糖酵解过程中的代谢产物所诱导。尽管已有研究指出这些修饰在细胞中的潜在存在,但它们在细胞核中的广泛分布情况以及与Warburg效应的关联性仍然是当前研究中的一个未解之谜。
2024年7月20日,北京大学生命科学学院、北大-清华生命科学联合中心张迪研究员,携手四川大学戴伦治教授、威斯康星大学李灵军教授以及芝加哥大学赵英明教授,在 Nature Chemical Biology 期刊发表了题为:Lysine L-lactylation is the dominant lactylation isomer induced by glycolysis 的研究论文。
该研究采用了正交技术区分了三种赖氨酸乳酰化修饰的同分异构体,并确立了L-乳酰化修饰在细胞响应糖酵解过程和Warburg效应中的核心作用。这一发现不仅深化了对蛋白质翻译后修饰异构体功能的理解,而且为相关领域的研究提供了新的分析方法和理论基础。

2019年,芝加哥大学赵英明教授团队发表 Nature 论文上首次揭示了Warburg效应的产物L-乳酸能够驱动一种新型蛋白质修饰——赖氨酸乳酰化,张迪为该论文的第一作者。
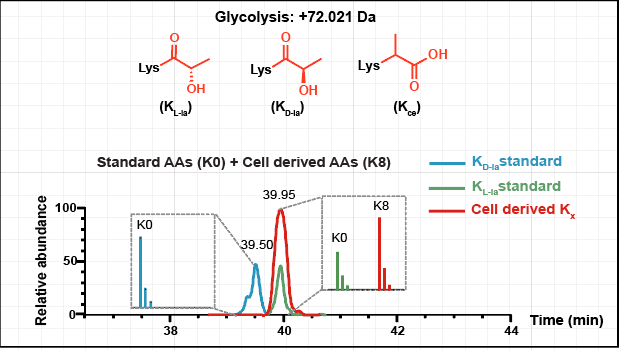
随后,该修饰的立体异构体修饰——赖氨酸D-乳酰化(KD-la)也被发现存在于细胞中。KD-la是通过乙二醛酶途径产生的S-D-乳酰谷胱甘肽(LGSH)与蛋白质发生的非酶催化反应形成。乙二醛酶途径,一个高效的细胞解毒系统,由乙二醛酶1(GLO1)和乙二醛酶2(GLO2)两种酶组成,GLO1将糖酵解副产品甲基乙二醛(MGO)与谷胱甘肽结合形成LGSH,而GLO2则将其水解,生成D-乳酸并再生谷胱甘肽。MGO的高反应性使其能与多种蛋白质残基反应,包括半胱氨酸、精氨酸和赖氨酸,其中与赖氨酸反应形成的N-ε-(羧乙基)赖氨酸(Kce)已在细胞中发现,尽管其水平低于MGO衍生的精氨酸残基修饰。目前,由于KL-la、KD-la和Kce具有相同的分子量和结构相似性,通过高效液相色谱-质谱(HPLC-MS)分析难以区分它们,且KD-la和Kce是否能响应细胞糖酵解的动态变化尚不明确。
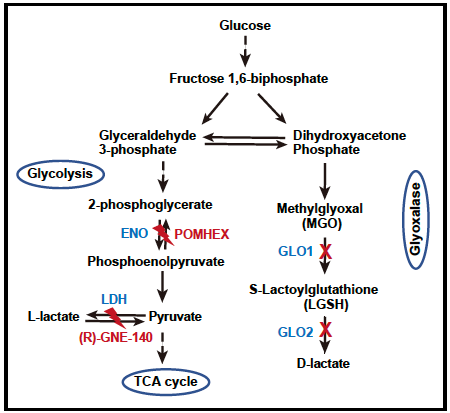
图2:糖酵解通路调控KL-la、KD-la和Kce三种乳酰化修饰异构体
为了解决这些基本问题,研究团队开发并应用了一系列正交技术,涵盖了分析化学、化学生物学和免疫学方法,专门用于区分KL-la、KD-la和Kce这三种乳酰化异构体。通过这些方法的建立和应用,该研究证明了KL-la是细胞组蛋白上的主要乳酰化形式,其产生受高葡萄糖浓度和糖酵解过程的诱导,并且与代谢物乳酰辅酶A(lactyl-CoA)的浓度呈正相关。此外,该研究还发现,在糖酵解的下段途径受阻或乙二醛酶系统功能不完整的情况下,KD-la和Kce可以产生并且受葡萄糖浓度影响,进一步揭示了这些异构体在细胞代谢调节中的复杂性。
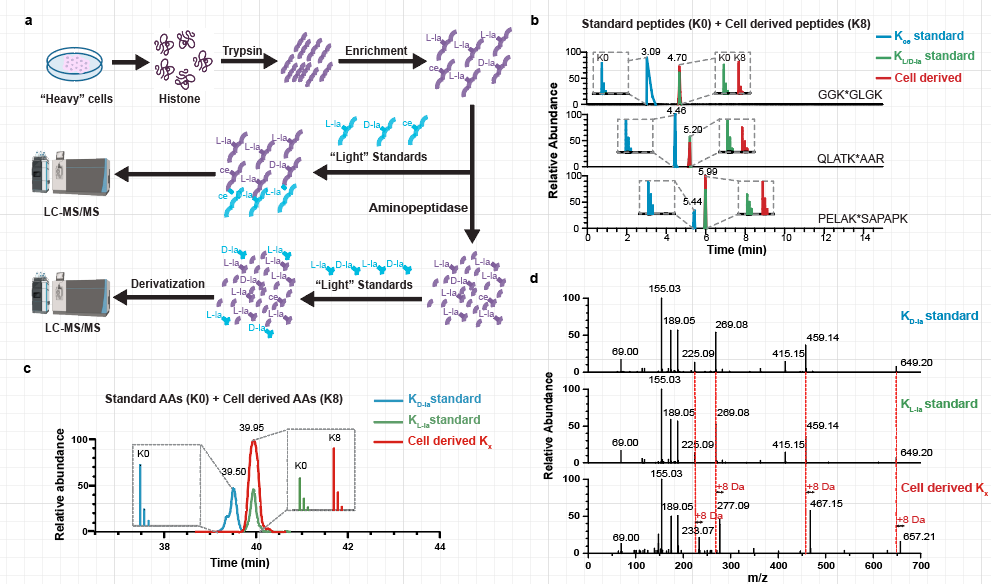
图3:用生物正交方法区分三种乳酰化修饰同分异构体,并证明KL-la是细胞内组蛋白上的主要乳酰化形式
综上所述,该研究不仅开发了一套区分蛋白质翻译后修饰(PTM)异构体的创新方法,而且揭示了KL-la作为细胞对糖酵解和Warburg效应的主要响应者的关键角色。这些成果不仅丰富了我们对细胞代谢调控机制的理解,而且为未来的研究提供了新的视角和工具,有助于深入探索乳酰化修饰在疾病发展和其他生物学过程中的作用。
北京大学生命科学学院张迪研究员、四川大学戴伦治教授、威斯康星大学麦迪逊分校李灵军教授以及芝加哥大学赵英明教授为论文共同通讯作者,北京大学张迪研究员、芝加哥大学高晋军博士(目前担任北京大学深圳研究院研究员)以及威斯康星大学麦迪逊分校朱致君博士为论文并列第一作者。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


