PNAS:娄继忠/许琛琦/陈伟合作揭示T细胞激活过程中TCR微簇的动态调控机制
来源:生物世界 2023-07-13 11:56
该研究发现了TCR通过内置的基于CD3ε/Lck的一套自编程的聚集以及解聚的机制来调控T细胞激活,从相分离的角度阐释了TCR信号通路敏感性以及快速性的分子机制,并且进一步的丰富了TCR基于Csk的负调
T细胞是适应性免疫的重要组成部分,TCR复合体作为T细胞膜表面最关键的膜受体,可以识别呈递外源抗原的MHC复合体并介导T细胞的激活以及对靶细胞进行清除。T细胞的激活过程具备三个主要特征:高特异性、高敏感性以及快速性。娄继忠以及陈伟课题组的早期研究发现TCR与不同的pMHC形成的复合体具备独特的力学性质,这使得TCR可以特异性的识别外来抗原。然而T细胞响应抗原的高敏感性以及快速性的机制仍不够清楚。
中国科学院生物物理研究所娄继忠课题组、中国科学院分子细胞卓越创新中心许琛琦课题组以及浙江大学医学院陈伟课题组合作,在 PNAS 上发表了题为:Self-programmed dynamics of T cell receptor condensation 的研究文章。

该研究发现,TCR复合体中CD3ε亚基的胞内域可以与下游的酪氨酸激酶Lck发生相分离,相分离不仅增强了CD3ε以及CD3ζ胞内域的磷酸化,而且进一步促进了Lck的激活,这种自我促进的相分离系统可以帮助T细胞仅凭少量的TCR激活即可快速的活化,同时发现了磷酸化CD3ε对Csk的招募可以破坏TCR/Lck的相分离进而抑制T细胞的过度活化。
该研究发现了TCR通过内置的基于CD3ε/Lck的一套自编程的聚集以及解聚的机制来调控T细胞激活,从相分离的角度阐释了TCR信号通路敏感性以及快速性的分子机制,并且进一步的丰富了TCR基于Csk的负调控机制。此外,这种自编程的相分离调控机制可能也参与其他膜受体的信号传导以及调控。
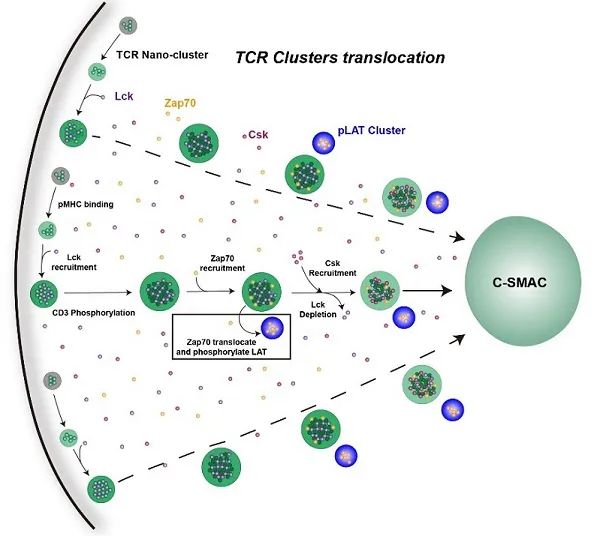
图:TCR/Lck相分离介导TCR信号转导的模式图
中科院生物物理所陈辉博士,中科院分子细胞卓越创新中心博士研究生徐心怡,以及浙大医学院第一附属医院肾脏病中心特聘研究员胡炜博士为论文共同第一作者;娄继忠研究员、许琛琦研究员以及陈伟教授为共同通讯作者;哈尔滨医科大学肿瘤医院娄长杰主任、清华大学刘万里教授以及美国宾夕法尼亚大学姜宁教授也在本项研究中做出了重要贡献。相关荧光成像工作在中国科学院生物物理所生物成像中心完成,该研究工作得到自然科学基金、中国科学院战略性先导科技专项项目(B类)、国家重点研发项目等基金的资助。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


