Nature子刊:发现新的细胞死亡机制,可为癌症治疗提供新策略
来源:生物探索 2023-02-16 17:29
德克萨斯大学MD安德森癌症中心甘波谊教授和陈俊杰教授团队又发现了一种新的细胞死亡机制——Disulfidptosis(双硫死亡),将为新的癌症治疗策略提供思路。
对于多细胞生物,其依赖于体内的每一个细胞而生存,细胞的新生、分化和死亡伴随着其一生的每时每刻。细胞死亡作为新陈代谢的环节之一,与细胞增殖、分化一样,对于生物生命的维持具有重要意义。在人体中,每天都有上百亿细胞死亡,若没有如此大规模的细胞死亡,则将如Gerry Melino(英国莱斯特大学细胞凋亡和癌症实验室负责人)所估计的那样,一个80岁的人将拥有16公里长的肠道和两吨重的骨髓和淋巴结。
除了因意外伤害导致的细胞死亡,很大一部分细胞在走向终点的时候,采用的是一种主动的“自杀行为”。由于在过程中涉及细胞内特定基因调控分子程序,这类“自杀行为”也称之为程序性细胞死亡(Programmed Cell Death,PCD)。PCD可以解释很多现象,如癌症和多囊肾就是一些细胞无法正常死亡造成的。没有PCD,人的手指与脚趾也无法形成正确的结构,而是会像鸭子的蹼一样彼此相连。
随着人们对细胞死亡的了解与日俱增,最初用于描述细胞死亡的词汇不足以对应已经明确具有不同机制的种种死亡方式,为了解决这一问题,细胞死亡命名委员会(Nomenclature Committee on Cell Death,NCCD)由此成立。2018年,NCCD以分子为导向的方式更新了最新版的细胞死亡分类系统,认定了细胞凋亡(apoptosis)、坏死性凋亡(necroptosis)、细胞焦亡(pyroptosis)、铁死亡(ferroptosis)、自噬依赖性细胞死亡(autophagy-dependent cell death)等十多种术语。然而在同年,又有两种新的细胞死亡方式被发现。
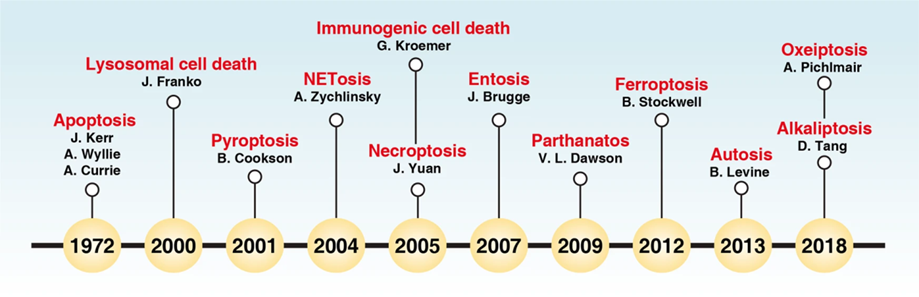
图1 细胞死亡方式发现时间(图源:[3])
外界环境的辐射、污染,细胞内的分子水平失衡都会导致DNA的损伤。PCD可以帮助我们清理掉那些DNA损伤严重程度超过DNA损伤反应(DNA damage response,DDR)系统修复能力的细胞。而一旦DDR系统和PCD系统都失效,则含有受损DNA的细胞会在体内不断有丝分裂,极可能在最终演变成癌症。
但另一方面,若肿瘤细胞可以程序性死亡,其速度将比增殖快20倍,因此,诱导肿瘤细胞的PCD系统恢复,也就成为了治疗癌症的一种策略。比如近些年来研究热度较高的铁死亡,就在某些情况下能够抑制肿瘤的生长。
近日,德克萨斯大学MD安德森癌症中心甘波谊教授和陈俊杰教授团队又发现了一种新的细胞死亡机制——Disulfidptosis(双硫死亡),将为新的癌症治疗策略提供思路。该发现以“Actin cytoskeleton vulnerability to disulfide stress mediates disulfidptosis”为题,发表于Nature Cell Biology。

图2 研究成果(图源:[4])
该机制与一种名为SLC7A11(Solute Carrier Family 7 Member 11)的蛋白有关。这种蛋白是溶质载体超家族的一员,与其他成员一样,是膜转运蛋白,可以促进各种营养物质和代谢产物的跨膜运输。而SLC7A11的功能即是将细胞外的胱氨酸(cystine)转运到胞内,同时将谷氨酸(glutamate)从胞内转运到胞外。与健康的细胞不同,癌细胞极其依赖胱氨酸的输入。许多癌症,如如肺癌和肾癌,都会出现SLC7A11的过度表达。
进入胞内的每个胱氨酸则会以消耗NADPH分子的方式,还原为两个半胱氨酸(cysteine),后者则可用于合成谷胱甘肽(Glutathione,GSH)。谷胱甘肽是人体内重要的抗氧化剂,具有抗氧化作用、整合解毒作用,如果你关心美白护肤产品,也许会在某些广告宣传中听到这个成分。
2020年,甘波谊教授团队及其合作者就已经发现,葡萄糖饥饿条件下,在过度表达SLC7A11的细胞内,NADPH分子的库存变得“入不敷出”,这就使得胱氨酸无法还原成为半胱氨酸的。就这样,胱氨酸及其他二硫化物在细胞内异常积累,最终导致二硫化物应激(disulfide stress)和细胞快速死亡。
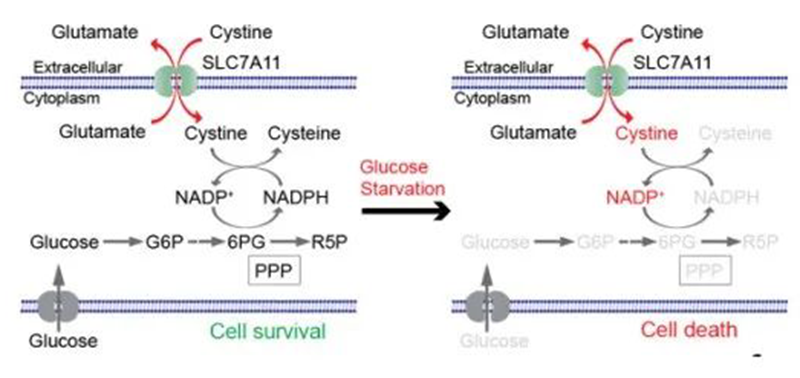
图3 葡萄糖饥饿条件下胱氨酸异常积累导致细胞死亡(图源:[4])
那么,二硫化物的异常积累又是如何导致细胞死亡的呢?研究人员首先通过排除法,证明葡萄糖饥饿诱导的SLC7A11高表达癌细胞死亡不属于任何已知的细胞死亡类型,比如该细胞死亡不能被铁死亡抑制剂等已知的细胞死亡抑制剂所影响,但能被防止二硫化物应激的多种还原剂所抑制。
研究人员进一步假设,偏离了正常水平的二硫化物会诱使某些蛋白上半胱氨酸残基的巯基形成分子间和/或分子内二硫键,进而破坏蛋白质的功能和活性,损害细胞活力。研究人员量化了葡萄糖饥饿后二硫键的变化情况,发现一系列肌动蛋白细胞骨架中的二硫键增加最为显著。
肌动蛋白细胞骨架由肌动蛋白丝组成,为细胞提供机械支持。二硫键的增加改变了肌动蛋白细胞骨架蛋白的动力学,将引起肌动蛋白网络崩溃和细胞死亡,在这一过程中,细胞形态也会发生显著变化,表现为细胞收缩、肌动蛋白丝收缩并脱离质膜。
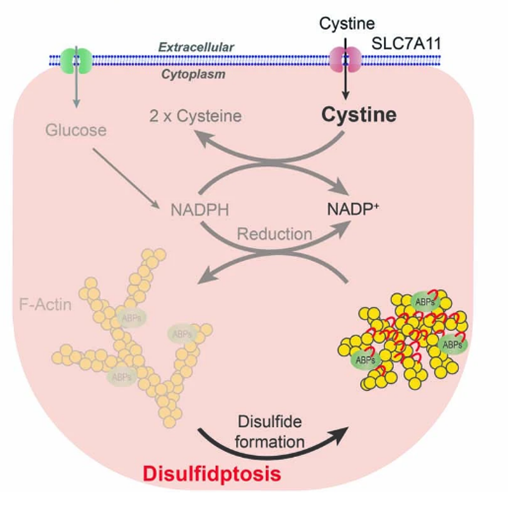
图4 二硫键的形成改变了肌动蛋白细胞骨架的动力学(图源:[4])
“由于SLC7A11在许多癌症中高度表达,因此有可能存在这样一个治疗窗口,可以通过抑制葡萄糖的转运诱发Disulfidptosis,同时不会影响到正常细胞。”
甘波谊教授表示,许多癌细胞能够逃避现有癌症治疗方法诱导的细胞凋亡,Disulfidptosis作为一种新发现的细胞死亡机制,值得作为新的癌症疗法进一步研究。而下一步,研究团队将探索如何在其他条件下引发Disulfidptosis,以及其他哪些通路也会触发Disulfidptosis,这些都有望为癌症治疗提供新的靶点。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


