2023年10月Science期刊精华
来源:生物谷原创 2023-10-31 10:15
2023年10月份即将结束,10月份Science期刊又有哪些亮点研究值得学习呢?小编对此进行了整理,与各位分享。
2023年10月份即将结束,10月份Science期刊又有哪些亮点研究值得学习呢?小编对此进行了整理,与各位分享。
1.Science:重大进展!破解降解有害蛋白的溶酶体靶向嵌合体作用机制新细节,有望开发出新的疾病治疗方法
doi:10.1126/science.adf6249
在靶向参与导致或传播疾病的有害蛋白时,药物通常会堵塞蛋白的活性位点,使其无法发挥作用并造成严重破坏。针对这些蛋白的新策略可以将它们送入不同类型的细胞蛋白降解机制,如细胞中就像蛋白碎木机那样起作用的溶酶体。
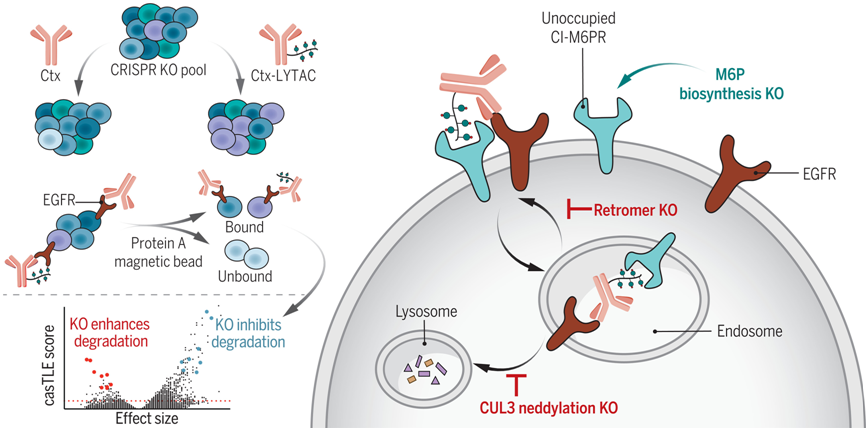
鉴定LYTAC介导的膜蛋白降解的细胞决定因素。图片来自Science, 2023, doi:10.1126/science.adf6249。
如今,在一项新的研究中,来自美国斯坦福大学的研究人员揭示了通往细胞溶酶体的其中一条途径是如何发挥作用的。在此过程中,他们就为针对老年相关疾病、自身免疫疾病和治疗抵抗性癌症的新疗法打开了大门。这些发现还可能改善溶酶体贮积症的治疗方法,其中溶酶体贮积症虽然罕见,但往往很严重,主要影响婴儿和儿童。相关研究结果发表在2023年10月20日的Science期刊上,论文标题为“Elucidating the cellular determinants of targeted membrane protein degradation by lysosome-targeting chimeras”。
在这项新的研究中,论文第一作者Green Ahn利用CRISPR基因筛选技术,确定并描述了调节LYTAC如何降解蛋白的细胞成分。通过这一筛选,这些作者发现了neddylated cullin 3 (CUL3)---一种在分解细胞蛋白过程中起着管家作用的蛋白---的水平与LYTAC疗效之间的联系。目前还不清楚这两者之间的确切联系,但是neddylated CUL3越多,LYTAC的疗效就越好。
测量neddylated CUL3的水平可以确定哪些患者更有可能对LYTAC疗法产生反应。Bertozzi说,这是一个令人惊讶的发现,因为以前的研究从未指出过这种相关性。
他们还发现了阻碍LYTAC发挥作用的蛋白。LYTAC通过与细胞外的某些受体结合来发挥作用,它们利用这些受体将有害的蛋白送入溶酶体进行降解。然而,他们发现,带有甘露糖-6-磷酸(mannose 6-phosphate, M6P)的蛋白会在这些受体上占据一席之地,这意味着 LYTAC 无法与之结合。通过破坏 M6P 的生物合成,细胞表面未被占用的受体数量增加,LYTACs就有可能劫持这些受体。
2.Science:重大进展!揭示CLN5基因编码的蛋白是BMP合酶,有望开发出治疗神经退行性疾病的新疗法
doi:10.1126/science.adg9288
作为细胞内的微小区室,溶酶体是需要降解的分子的垃圾处理器,对细胞功能和人体健康至关重要;溶酶体蛋白的功能紊乱与多种神经退行性疾病有关。确定编码这些蛋白的基因发生突变如何导致疾病,不仅能让科学家们更好地了解疾病,还能为他们提供新的治疗方法。
在一项新的研究中,美国斯坦福大学化学工程助理教授和遗传学助理教授Monther Abu-Remaileh及其研究团队确定了一种称为CLN5的溶酶体蛋白的功能,已知这种蛋白在一种罕见但致命的神经退行性疾病中失调。相关研究结果近期发表在Science期刊上,论文标题为“The Batten disease gene product CLN5 is the lysosomal bis(monoacylglycero)phosphate synthase”。
图片来自Science, 2023, doi:10.1126/science.adg9288。
他的研究小组发现,这种蛋白驱动着一种名为双(单酰基甘油)磷酸酯--- bis(monoacylglycero)phosphate,缩写为BMP---的脂质分子合成中的一个关键步骤,已知 BMP 在阿尔茨海默病、帕金森病和其他神经退行性疾病中起着至关重要的作用。揭示这种长期难以发现的蛋白不仅为科学家们开发治疗这些疾病的新药提供了线索,而且还为细胞生物学建立了一种新的模式:溶酶体一直被认为是分子降解的中心,但它同时也是分子制造的场所。
Abu-Remaileh说,“既然我们知道了细胞如何制造BMP,我们就能开发出激活它的方法,并有望找到对抗和改善与年龄相关的神经退行性病变的方法。”
3.Science:揭示蛋白激酶PIM1控制GBP1 蛋白活性机制,有望开发出针对传染病和癌症的新疗法
doi:10.1126/science.adg2253
一种称为GPB1的蛋白能够攻击受感染细胞中的微生物。GBP1 在炎症过程中被激活,有可能攻击细胞膜并破坏它们。在一项新的研究中,来自英国伯明翰大学和弗朗西斯-克里克研究所等研究机构的研究人员发现了一种控制蛋白GPB1的“保护机制”,这就为开发针对弓形虫、衣原体、结核病甚至癌症的新疗法提供了可能。相关研究结果发表在2023年10月6日的Science期刊上,论文标题为“PIM1 controls GBP1 activity to limit self-damage and to guard against pathogen infection”。
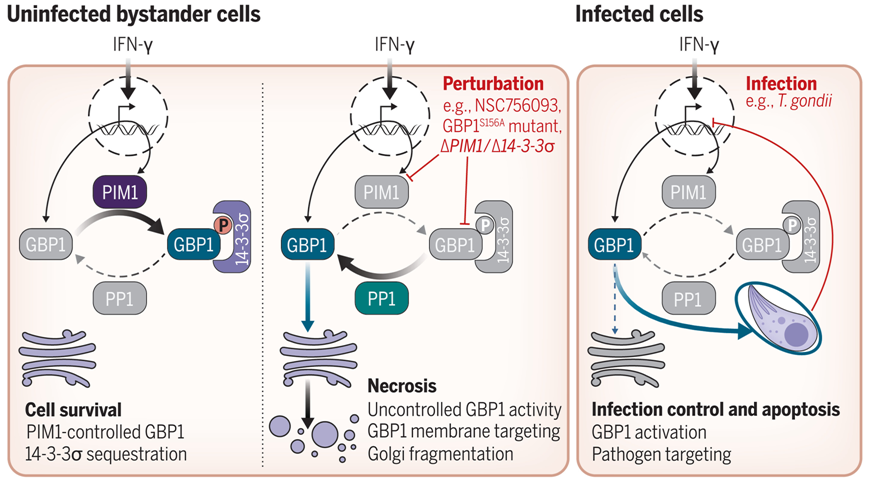
蛋白激酶PIM1控制GBP1的活性。图片来自Science, 2023, doi:10.1126/science.adg2253。
这些作者揭示了这种攻击细胞中微生物的蛋白如何通过一种叫做磷酸化的过程加以控制,在这种过程中,一种叫做蛋白激酶的酶会在蛋白上添加一个磷酸基团。靶向GBP1 的激酶被称为 PIM1,在炎症期间也会被激活。磷酸化的 GBP1 反过来又与一种支架蛋白结合,使未感染的旁观者细胞免受不受控制的 GBP1细胞膜攻击和细胞死亡。这种新发现的锁-钥机制可以防止GPB1不加选择地攻击细胞膜,从而形成一种对细胞内病原体的破坏敏感的保护机制。
论文通讯作者、伯明翰大学高级研究员Eva Frickel博士补充说,“这一发现意义重大,原因有几个。首先,像控制 GBP1 这样的防护机制已知存在于植物生物学中,但在哺乳动物中却鲜为人知。可以把它想象成一把锁-钥系统。GPB1想出去攻击细胞膜,但PIM1是钥匙,这意味着GPB1被安全地锁在外面。第二个原因是,这一发现可能具有多种治疗用途。如今我们知道了 GBP1 是如何被控制的,我们就可以探索随意开启和关闭这一功能的方法,利用它来杀死病原体。”
4.Science:揭示致病的耳念珠菌具有极强的表面粘附能力之谜
doi:10.1126/science.adf8972
2009 年,一种神秘的真菌似乎凭空出现,目标是人类当中最脆弱的群体。这听起来像是好莱坞的故事,但这种真菌却构成了非常现实的威胁。科学家们正在争分夺秒地研究,是什么导致了这种威胁生命的真菌---耳念珠菌(Candida auris),以及为什么即使是医院和其他医疗机构最好的感染控制方案也常常无法消灭它。
在一项新的研究中,来自美国密歇根大学的研究人员对耳念珠菌粘附在从皮肤到导管等各种物体上的神奇能力进行了研究,并有了惊人的发现。相关研究结果近期发表在Science期刊上,论文标题为“A Candida auris-specific adhesin, SCF1, governs surface association, colonization, and virulence”。
论文通讯作者、密歇根大学医学院微生物学与免疫学系的Teresa O'Meara博士和她的研究生Darian Santana领导的一个研究团队发现耳念珠菌与其他已知真菌不同,它使用一类称为粘附素(adhesin)的蛋白,其作用与藤壶和软体动物等海洋生物使用的蛋白非常相似。
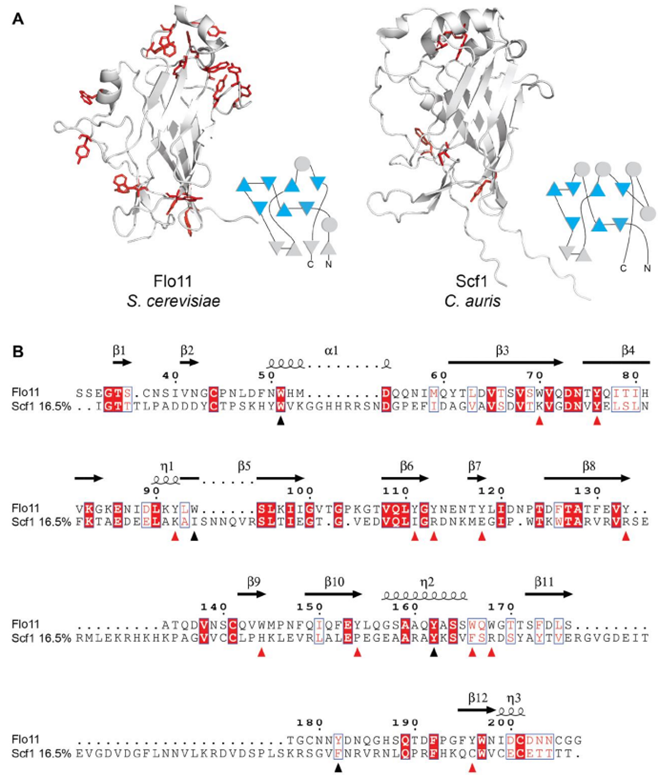
SCF1的N端结构域包含一个类似Flo11的III型纤维连接蛋白褶皱,但缺乏对Flo11功能至关重要的保守性芳香氨基酸残基。图片来自Science, 2023, doi:10.1126/science.adf8972。
他们最初的假设是,耳念珠菌使用的粘附素来自其他真菌(比如白色念珠菌)使用的粘性蛋白家族。然而,当他们探究常见的嫌疑对象---高度保守的 ALS 和 IFF/HYR 家族的蛋白---时,除了一种称为IFF4109的蛋白有部分影响外,它们中的大部分都没有发现。
随后,他们转而采用另一种筛选方法,即系统地破坏耳念珠菌的基因组,观察哪种突变体失去了粘附96孔塑料板的能力,结果发现了一种新的粘附素,他们将其命名为表面定殖因子(Surface Colonization Factor, SCF1)。他们还发现,SCF1 与定殖增加和致病能力增强有关。他们利用小鼠模型证明,SCF1和IFF4109的缺失会降低耳念珠菌菌株在皮肤和留置导尿管中的定植能力。此外,过度表达 SCF1 的耳念珠菌菌株毒力增强,真菌病变增多。
5.Science:重大进展!利用经过基因改造的益生菌引导CAR-T细胞有望成为一种安全有效治疗实体瘤的通用平台
doi:10.1126/science.add7034
几年来,科学家们已经成功地利用嵌合抗原受体(CAR)T细胞(CAR-T)靶向血细胞表面上的特定抗原来治疗白血病和淋巴瘤患者。但事实证明,利用CAR-T细胞靶向实体瘤(如乳腺癌和结肠癌)是特别困难的。实体瘤含有一系列显示出不同抗原的细胞,而且体内的健康细胞也往往携带这些抗原。因此,确定一种一致且安全的肿瘤靶标阻碍了大多数治疗实体瘤的 CAR-T 细胞疗法在开发的第一阶段取得成功。
在一项新的研究中,来自美国哥伦比亚大学的研究人员报告了一种攻击肿瘤的新方法。他们设计了肿瘤定植细菌(益生菌),让定植在肿瘤中的它们产生合成靶标,从而引导 CAR-T 细胞消灭这些含有合成靶标的癌细胞。相关研究结果发表在2023年10月13日的Science期刊上,论文标题为“Probiotic-guided CAR-T cells for solid tumor targeting”。
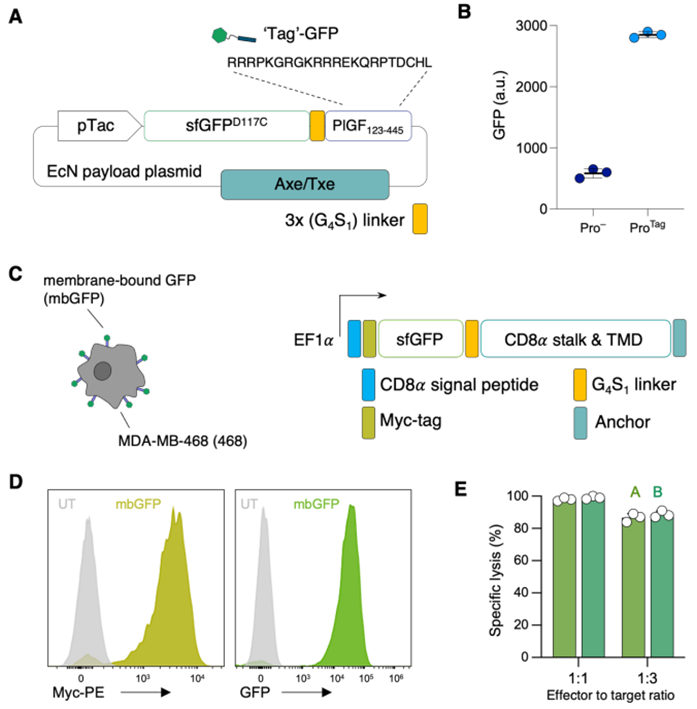
图片来自Science, 2023, doi:10.1126/science.add7034。
论文通讯作者、哥伦比亚大学生物医学工程学副教授Tal Danino说,“我们的益生菌平台能让CAR-T细胞攻击多种类型的肿瘤。传统的 CAR-T细胞疗法依赖于靶向天然肿瘤抗原。这是第一个将经过基因改造的T 细胞与经过基因改造的细菌配对,安全、系统、有效地向实体瘤递送合成抗原的例子。这将对许多癌症的治疗产生重大影响。”
Danino实验室通过对寻找肿瘤的细菌进行编程,在实体瘤上涂上CAR-T细胞能够识别的合成抗原,从根本上构建出能够攻击通用抗原的通用CAR-T细胞。这种益生菌引导的CAR-T细胞(probiotic-guided CAR-T cell, ProCAR)平台是这些作者首次成功地将经过基因改造的益生菌与CAR-T细胞结合在一起,而且还首次证明了CAR-T细胞对直接在肿瘤内产生的合成抗原有反应。
论文共同第一作者、Danino实验室博士生Rosa Vincent说,“将靶向肿瘤的细菌和CAR-T细胞结合在一起的优势,提供了一种新的肿瘤识别策略,这为开发经过基因改造后用于活体疗法的细菌群落奠定了基础。我们选择将这两种细胞疗法的最佳特点---利用细菌产生肿瘤靶标,利用T细胞消灭恶性肿瘤细胞---结合起来,从而弥补这两种疗法各自的局限性。”
6.Science:发现库普弗细胞样合胞体在纤维化肝脏中补偿驻留巨噬细胞的功能
doi:10.1126/science.abq5202
在一项新的研究中,来自加拿大卡尔加里大学和德国柏林夏里特医学院的研究人员首次观察到肝脏如何在疾病的情况下保持它的细菌过滤功能。据此,他们发现了肝病中一种以前未知的代偿机制:如果肝脏中的一种特殊免疫细胞---库普弗细胞(Kupffer cell)---因组织瘢痕而受损,那么源自骨髓的免疫细胞就会流向肝脏,并在那里形成更大的细胞簇,以执行相同的功能。这些发现可能有助于开发治疗肝脏损伤的新疗法。相关研究结果近期发表在Science期刊上,论文标题为“Kupffer cell–like syncytia replenish resident macrophage function in the fibrotic liver”。
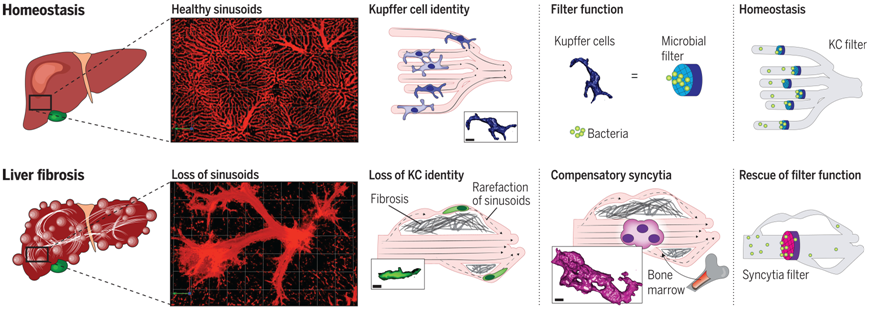
纤维化性肝病中的库普弗细胞适应。图片来自Science, 2023, doi:10.1126/science.abq5202。
他们利用一种创新的显微镜技术和其他显微镜技术,仔细研究了动物模型和肝硬化患者组织样本中库普弗细胞的功能。在此过程中,他们发现了一种新的细胞类型,他们称之为库普弗细胞样合胞体(Kupffer cell–like syncytia)。这些细胞是一类巨大的细胞---由源自骨髓的免疫细胞形成的更大的多核细胞团,这些细胞在反应过程中到达现场。
论文共同第一作者、柏林夏里特医学院的Moritz Peiseler博士描述了在肝脏瘢痕和重塑过程中发生的事情,“越来越多的肝细胞死亡。结缔组织在整个肝脏器官和小血管周围形成。血液重新流向肝脏内外新的、扩张的血管。这导致库普弗细胞与周围环境失去联系,因此它们最终不再像在肝脏中那样活动。它们失去了功能,不再从血液中捕捉细菌,血液中的感染就会增加。没过多久,来自骨髓的免疫细胞---特化单核细胞---就会渗入肝脏。它们沿着绕过先前结构的侧支血管形成足够大的细胞簇,以过滤掉稍大血管中的细菌。”这是肠道微生物组引发的一种拯救生命的补偿形式。
这些新形成的库普弗细胞样合胞体从此接管了真正的 库普弗细胞的过滤功能。由于它们必须存在于发生变化的血管内,因此这些迁移到该部位的免疫细胞会进行调整,形成网状结构,使其成为有效的微生物过滤器。这些作者在这项新的研究中描述了这些过程所涉及的分子机制。
7.Science:新研究揭示短串联重复序列如何影响基因表达
doi:10.1126/science.add1250
几十年来,科学家们已经知道,“垃圾 DNA(junk DNA)”实际上起着至关重要的作用:尽管基因组中的蛋白编码基因提供了构建蛋白的蓝图,但是基因组中的一些非编码部分,包括以前被认为是 “垃圾DNA”的基因组区域,似乎可以提高或降低这些基因的表达。但人们一直不清楚某些非编码区域如何影响基因表达水平。
如今,在一项新的研究中,美国斯坦福大学医学中心生物工程副教授和遗传学副教授Polly Fordyce博士及其同事们揭开了其中的一些谜团。他们的发现可能有助于科学家们理解复杂的遗传疾病,包括自闭症、精神分裂症、癌症和克罗恩病。相关研究结果近期发表在Science期刊上,论文标题为“Short tandem repeats bind transcription factors to tune eukaryotic gene expression”。

STR直接结合转录因子,从而改变基因表达。图片来自Science, 2023, doi:10.1126/science.add1250。
Fordyce说,“我们早就知道短串联重复序列(short tandem repeat, STR)不是垃圾DNA,因为它们的存在与否与基因表达的变化有关。但我们还不知道它们是如何产生这些影响的。”在这项新的研究中,这些作者首次为理解STR变化如何影响基因表达提供了路线图。
doi:10.1126/science.adg1075
和突触后膜组成。由于神经递质只存在于突触前膜的突触小泡(synaptic vesicle)中,只能由突触前膜释放,然后作用于突触后膜,所以神经元之间兴奋的传递只能是单向的。在这些突触处,电脉冲被转化为化学信使,可被邻近的突触后神经元接收和感知。除了传递信息,突触还能存储信息。虽然人们对突触的结构和功能有了相当深入的了解,但对突触是如何形成的却知之甚少。
在一项新的研究中,来自德国莱布尼兹分子药理学研究所、柏林夏里特医学院、马克斯-德尔布吕克分子医学中心、莱比锡大学、美国芝加哥大学和英国谢菲尔德大学的研究人员揭开了这一谜团。相关研究结果发表在2023年10月13日的Science期刊上,论文标题为“Phosphatidylinositol 3,5-bisphosphate facilitates axonal vesicle transport and presynapse assembly”。

图片来自Science, 2023, doi:10.1126/science.adg1075。
为了从一开始就跟踪突触前膜的形成,这些作者使用CRISPR基因剪刀将荧光蛋白插入人类干细胞,并用改造后的干细胞生成神经元。有了这种荧光标记,他们如今就能在显微镜下直接观察发育中的人类神经细胞中新生突触小泡的发育情况。
论文通讯作者Volker Haucke教授说,“突触小泡蛋白和所谓‘活性区(active zone)’中的蛋白,以及很可能将突触连接在一起的粘附蛋白,都共享同一条总线。这一发现引起了很大争议。但我们在体外培养的人类神经元中获得的数据似乎非常清晰。”
但是,这些蛋白究竟是如何到达突触形成部位的呢?在这项新的研究中,这些作者能够证实一种马达蛋白(motor protein)分子机器为轴突运输提供了动力。根据他们的研究结果,主要驱动力是一种名为 KIF1A 的驱动蛋白(kinesin)。这种马达蛋白因与外周神经系统和大脑中的神经系统疾病有关而最为人熟知。
doi:10.1126/science.adh0059
每个人类细胞都有一套完全相同的基因。在我们的细胞深处,一个名为 PRC2 的分子机器在决定哪些细胞成为心脏细胞、哪些细胞成为脑细胞、哪些细胞成为肌肉细胞或皮肤细胞的过程中起着至关重要的作用。
如果这个分子机器缺失或损坏,胎儿就无法正常发育。如果它发生突变,细胞就会不受控制地生长,癌症就会出现---这使得 PRC2 成为药物开发者热衷的对象。
在一项新的研究中,来自美国科罗拉多大学博尔德分校和哈佛医学院的研究人员提供了一个前所未有的视角,研究PRC2(polycomb repressive complex 2, 多聚核抑制复合物2)是如何发挥作用的,特别是核糖核酸(RNA)是如何帮助它开启和关闭基因的。这些发现为人们为发育如何发生提供了新的见解,并为开发治疗血癌、胰腺癌、结肠癌、白血病和小儿肿瘤等难治癌症的新疗法铺平了道路。相关研究结果近期发表在Science期刊上,论文标题为“Structural basis for inactivation of PRC2 by G-quadruplex RNA”。

图片来自Science, 2023, doi:10.1126/science.adh0059。
论文共同通讯作者、科罗拉多大学博尔德分校生物化学助理教授 Vignesh Kasinath 说,“我们知道 PRC2 对发育和维持细胞身份极为重要,我们也知道 RNA 对它有调控作用。但从机理上讲,我们并不知道这是如何调控的。”
在这项新的研究中,Kasinath实验室与诺贝尔奖获得者Thomas Cech及其同事们合作,利用最先进的“低温电镜”技术拍摄了PRC2的活动过程。这项技术是将样品冷冻到极低的温度,以保存其原始结构,然后用电子束以超过光速的速度照射样品,以生成超高分辨率的三维图像。
10.Science:在单分子水平上直接观察与蛋白和脂质结合的聚糖的序列和位置
doi:10.1126/science.adh3856
在一项新的研究中,来自德国马克斯-普朗克固体研究所、图宾根大学和丹麦哥本哈根大学的研究人员报告了一种在单分子水平上拍摄与几种生物分子结合的聚糖(glycan)---又称多糖---的序列和位置的方法。相关研究结果发表在2023年10月13日的Science期刊上,论文标题为“Direct observation of glycans bonded to proteins and lipids at the single-molecule level”。

MUC1糖蛋白的表面结构。MUC1的放大扫描隧道显微镜图片显示了聚糖和蛋白部分,通过解析得到MUC1表面的分子结构。图片来自Science, 2023, doi:10.1126/science.adh3856。
在进行了大量实验寻找聚糖结合的成像方法后,这些作者找到了一种电喷雾技术,它能将与脂质和蛋白分子结合的聚糖(称为糖胺聚糖和糖结合物)结合到两个金属-----银和铜---表面上。这样,他们就能利用扫描隧道显微镜直接对这些聚糖分子进行成像。他们能够识别聚糖链中的特定单糖,进而能够进一步了解聚糖的方向及其在蛋白骨架上的附着位置。
这些作者还通过获取与粘蛋白结合的氧连接聚糖的图片展示了他们的新成像技术,并指出,这些图片可能有助于寻找早期的癌症生物标志物。这项技术可用于多种研究工作,甚至可能有助于发现未知的糖脂和/或糖蛋白。(生物谷 Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


