《BMC医学》:国内首次!宣武医院贾建平团队发现阿尔茨海默病新机制
来源:奇点糕 2023-07-14 15:01
贾建平团队基于我国一个FAD家系,发现了一个全新的阿尔茨海默病病理基因突变,并揭示了背后的机制,让我们对阿尔茨海默病有了新的认知。
阿尔茨海默病是一种非常复杂的神经退行性疾病。
科学家已经在家族性阿尔茨海默病(FAD)患者体内发现APP和PSEN1/2等基因突变,然而这些目前已知的突变只发生在大约10-20%的FAD患者中。绝大部分FAD的遗传因素目前仍不为人知。
近日,由首都医科大学宣武医院贾建平领衔的研究团队,在著名期刊BMC Medicine上发表了一项重要研究成果[1],让我们对阿尔茨海默病的发病机制有了新的认知。
他们在中国FAD患者体内发现了一个罕见的ZDHHC21基因功能增益突变,突变后的ZDHHC21T209S蛋白会提升Aβ前体蛋白(APP)和酪氨酸蛋白激酶FYN的棕榈酰化水平,一方面导致APP更容易融入细胞膜,被切割成有毒的Aβ40和Aβ42,另一方面通过FYN通路损害突触功能,导致神经元死亡。
据了解,这是我国科学家首次在中国人群APP和PSEN1/2之外的基因上发现阿尔茨海默病致病基因突变。这一发现不仅让我们对阿尔茨海默病的病理过程有了新认知,也提示棕榈酰化抑制剂可能是治疗阿尔茨海默病的潜在药物。

论文首页截图
贾建平团队的这一新发现源于一名就诊患者。
这名患者55岁,2015年因为记忆衰退到宣武医院神经科就诊。两年前,她变得生活无法自理,在医院的记忆门诊几乎不能回答医生提出的问题。经神经系统检查提示认知障碍之后,患者接受了大脑的PET和CT检查,发现双侧额叶、顶叶和外侧颞叶皮层中存在大量Aβ沉积,海马体也严重萎缩。
考虑到这名患者的母亲和一名兄弟曾确诊阿尔茨海默病,贾建平团队给这名患者做了基因测序,但是没有发现任何已知的阿尔茨海默病致病性突变。为了找到可能的致病基因,研究人员给这个FAD家系中的几名成员做了外显子测序。结果在ZDHHC21基因的第6号外显子上找到了一个新的、杂合的、错义的突变(T209S)。
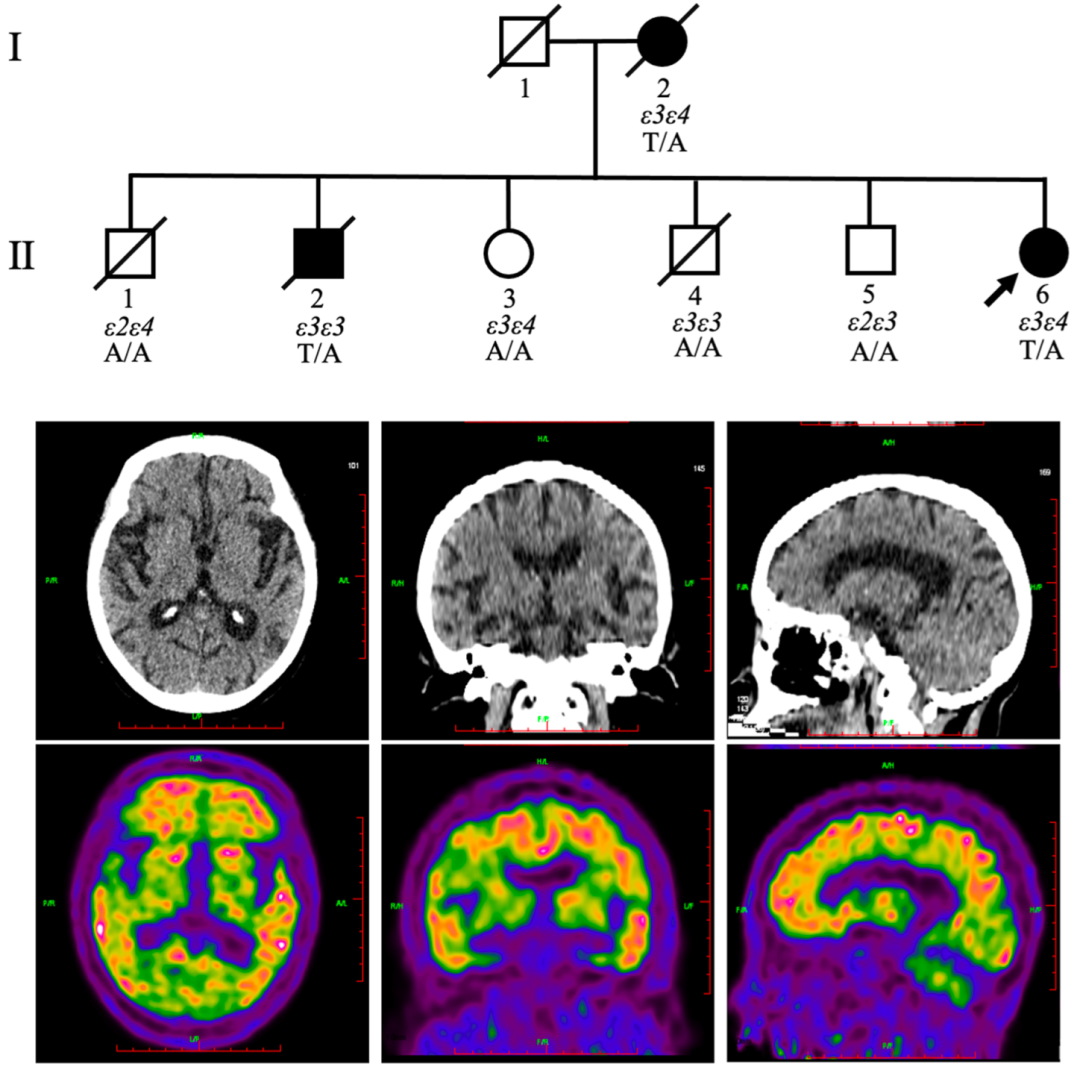
患者的基本情况
由于这个突变在已知的相关数据库中都不存在,贾建平团队决定在小鼠体内研究这个突变的功能。基于CRISPR/Cas9基因编辑技术,他们构建了一个纯合的ZDHHC21T209S突变小鼠模型。初步观察结果表明,这个突变没有影响小鼠的神经运动功能,但是显著损害了小鼠的学习和记忆保持能力。也就是说,ZDHHC21T209S突变会诱发小鼠的认知障碍。
随后他们研究了T209S突变在分子层面对小鼠的影响。首先看来,这个突变对小鼠大脑中ZDHHC21的mRNA和蛋白水平没有影响。为了缩小范围,研究人员查阅了受ZDHHC21影响的蛋白,结果发现APP和FYN可能是ZDHHC21棕榈酰化的底物[2,3]。
初步研究结果表明,与野生型小鼠的海马体相比,ZDHHC21T209S突变小鼠海马体中APP和FYN的棕榈酰化水平分别升高47.6%和25.2%,而APP和FYN的表达水平在两组之间没有差异。这表明ZDHHC21T209S是一个功能增益突变,导致酶的活性增加。
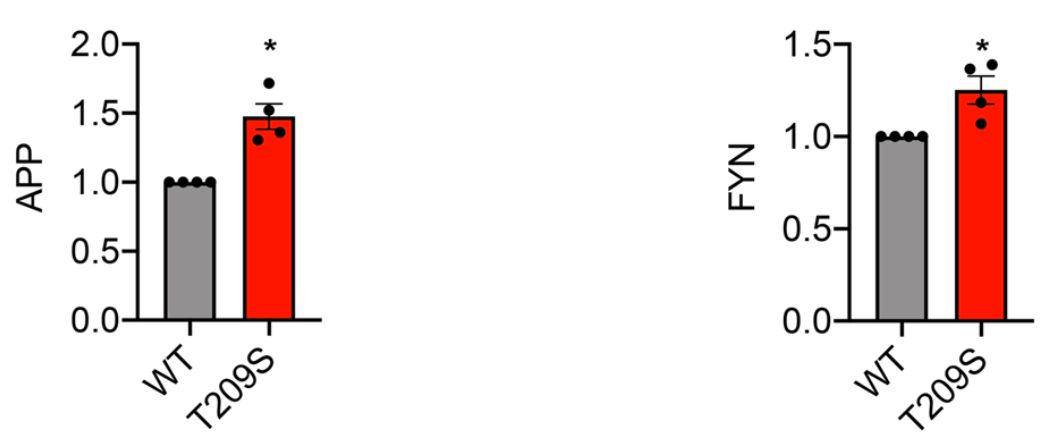
海马体中APP和FYN的棕榈酰化水平升高
接下来的问题是,APP和FYN的过度棕榈酰化与阿尔茨海默病究竟有什么关系。
先来看APP及下游Aβ蛋白水平的变化。
研究结果让人吃惊:与野生型小鼠相比,突变鼠海马体中阿尔茨海默病毒蛋白Aβ40和Aβ42分别升高53.0%和129.7%;Aβ42与Aβ40的比率升高56.7%;此外,突变鼠tau的Thr181、Thr217、Thr231和Ser396处磷酸化程度也更高。不难看出,ZDHHC21T209S突变会在小鼠体内诱发Aβ积累和tau的过度磷酸化。
至于背后的原因,根据现有的文献资料来看的话,棕榈酰化的APP优先进入细胞膜的脂质筏,然后被定位于此的BACE1和γ-分泌酶切割[2,4,5]。因此,棕榈酰化水平高的APP会产生更多的Aβ。
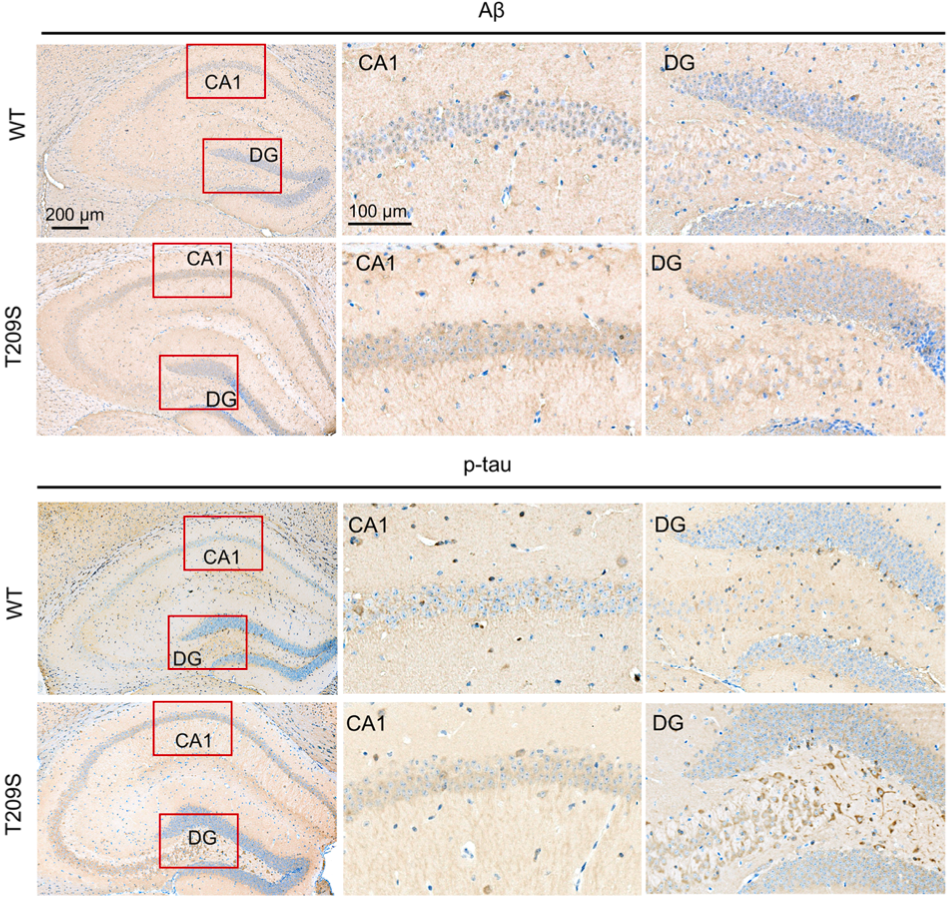
ZDHHC21T209S突变对Aβ和tau的影响
在随后的研究中,贾建平团队发现ZDHHC21T209S突变小鼠的大脑内存在神经元凋亡,功能性突触密度降低,突触可塑性下降等问题。
值得注意的是,他们发现ZDHHC21T209S突变导致的突触功能障碍是通过FYN及下游信号通路介导的。用棕榈酰化抑制剂纠正FYN的棕榈酰化水平,可以恢复突触的功能。
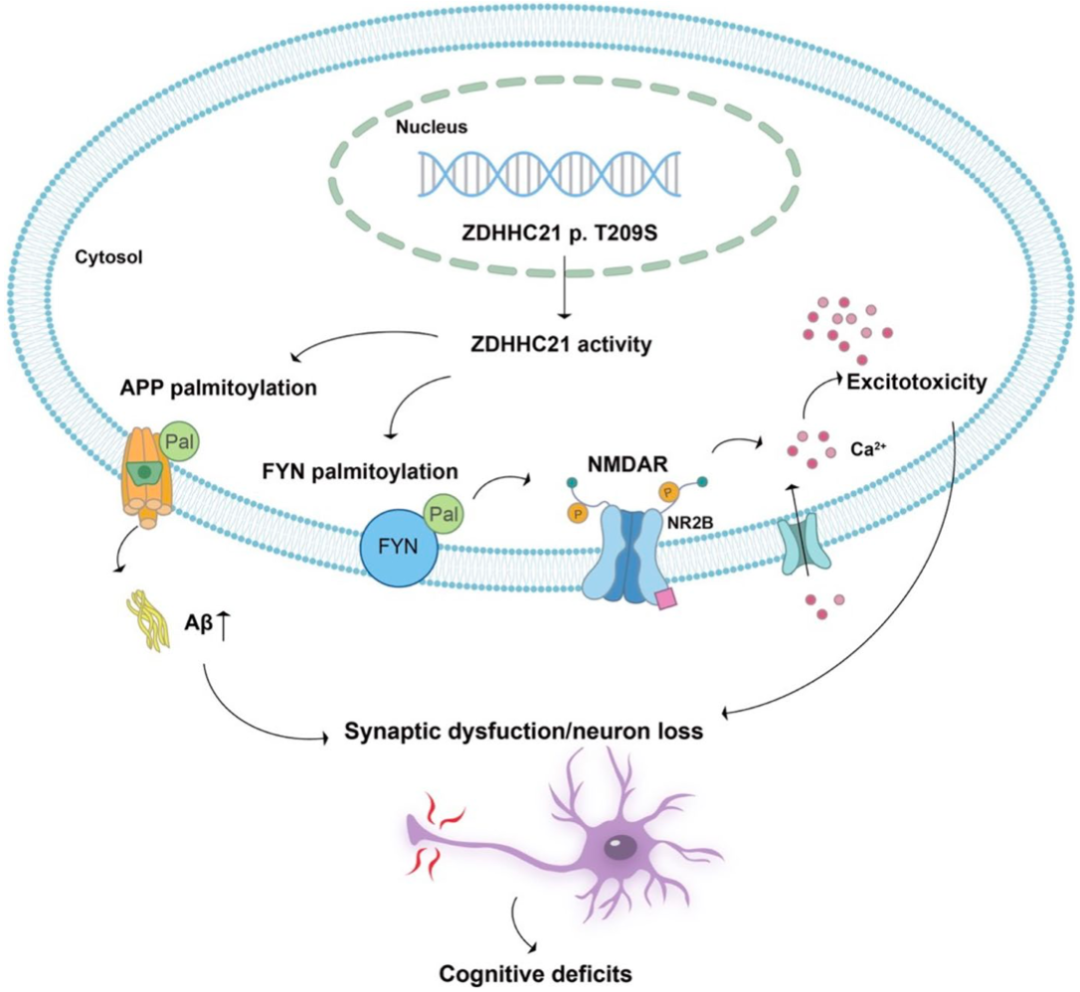
机制示意图
总的来说,贾建平团队基于我国一个FAD家系,发现了一个全新的阿尔茨海默病病理基因突变,并揭示了背后的机制,让我们对阿尔茨海默病有了新的认知。
更重要的是,对于缺乏真正有效疗法的阿尔茨海默病来说,这个新靶点的发现给阿尔茨海默病新药的开发也指出了一个新方向。期待相关药物的基础和临床研究尽快展开。
参考文献:
[1].Li W, Pang Y, Wang Y, et al. Aberrant palmitoylation caused by a ZDHHC21 mutation contributes to pathophysiology of Alzheimer's disease. BMC Med. 2023;21(1):223. Published 2023 Jun 26. doi:10.1186/s12916-023-02930-7
[2].Bhattacharyya R, Barren C, Kovacs DM. Palmitoylation of amyloid precursor protein regulates amyloidogenic processing in lipid rafts. J Neurosci. 2013;33(27):11169-11183. doi:10.1523/JNEUROSCI.4704-12.2013
[3].Jin J, Zhi X, Wang X, Meng D. Protein palmitoylation and its pathophysiological relevance. J Cell Physiol. 2021;236(5):3220-3233. doi:10.1002/jcp.30122
[4].Zhang X, Song W. The role of APP and BACE1 trafficking in APP processing and amyloid-β generation. Alzheimers Res Ther. 2013;5(5):46. Published 2013 Oct 8. doi:10.1186/alzrt211
[5].Bera S, Camblor-Perujo S, Calleja Barca E, et al. AP-2 reduces amyloidogenesis by promoting BACE1 trafficking and degradation in neurons. EMBO Rep. 2020;21(6):e47954. doi:10.15252/embr.201947954
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


