CMI | 武汉大学林丹丹/钟波/陈小奇发现双硫仑通过靶向RNF115改善STING/MITA依赖性炎症和自身免疫
来源:生物探索 2024-02-01 10:34
STING的功能获得突变(其中最常见的是STINGN154s和STING V155M)介导下游信号通路的激活,导致一种称为STING的自身免疫性疾病,与婴儿期发病相关的血管病变(SAVI)。
武汉大学林丹丹、钟波及陈小奇共同通讯在Cellular & Molecular Immunology(IF 24)在线发表题为“Disulfiram ameliorates STING/MITA-dependent inflammation and autoimmunity by targeting RNF115”的研究论文,该研究发现STING介导的炎症和自身免疫可由RNF115促进,并可由RNF115抑制剂双硫仑(DSF)缓解。在Trex1-/-小鼠和STINGN153S/WT骨髓嵌合小鼠中,敲除RNF115或用DSF治疗可显著抑制全身炎症和自身免疫致死性,恢复免疫细胞发育。
此外,RNF115的敲低或药理抑制可显著下调外周血中dsDNA浓度较高的系统性红斑狼疮(SLE)患者外周血中IFN-α、IFN-γ和促炎细胞因子的表达。从机制上讲,敲除或抑制RNF115会损害转染cGAMP的各种类型的细胞以及Trex1-/-小鼠的器官和细胞中STING的寡聚化和高尔基体定位。有趣的是,敲除RNF115会抑制髓细胞中STINGN153S的激活和高尔基定位以及促炎细胞因子的表达,而内皮细胞和成纤维细胞则不会。这些发现突出了RNF115介导的STING和STINGN153S的细胞类型特异性调控,并为STING相关自身免疫性疾病提供了潜在的靶向干预策略。

在稳态条件下,宿主DNA被隔离在细胞核或线粒体中。在应激条件下,核DNA或线粒体DNA (mtDNA)渗漏到细胞质中并在细胞质中积累,或者在DNA酶II和TREX1等基因突变的作用下,激活cGAS-cGAMP-STING轴,诱发严重炎症。例如,TREX1是一种降解自身DNA的DNA外切酶,TREX1的功能丧失突变与人类自身免疫性疾病密切相关,如Aicardi-Goutieres综合征(AGS)、视网膜血管病变伴脑白质营养不良(RVCL)和系统性红斑狼疮(SLE)。TREX1的功能缺失突变或敲除导致细胞质中自身DNA的积累和cGAS-cGAMP-STING通路的持续激活,从而引发自身免疫反应。因此,Trex1-/-和TREX1D18N小鼠会出现严重的全身性炎症,并表现出致命的自身免疫,这种免疫可以通过STING的缺失在基因上得到拯救,这表明STING在由自身DNA引起的自身免疫性疾病中发挥着重要作用。
除了胞质DNA外,STING的功能获得突变(其中最常见的是STINGN154s和STING V155M)介导下游信号通路的激活,导致一种称为STING的自身免疫性疾病,与婴儿期发病相关的血管病变(SAVI)。SAVI患者表现为全身性炎症、间质性肺疾病、外周血单个核细胞(PBMCs)中IFN产生和ISG特征表达旺盛。在小鼠模型中,携带STINGN153S或STINGV154M突变(分别与人类STINGN154S或STINGV155M同源)的杂合敲入小鼠表现出骨髓细胞扩增、T细胞减少、肺部炎症和过早死亡。
激活功能性NF-κB途径和炎症基因特征,而不是激活IRF3途径,在STINGN153S小鼠中起主导作用,因为在STINGN153S小鼠中删除IRF3、IRF7或IFNR1不能挽救致命的自身免疫表型。在机制上,在缺乏cGAMP的情况下,获得功能的STING突变体会自发和组成性地从内质网转移到高尔基体,从而触发炎症细胞因子的诱导。然而,STING的功能获得突变体是否需要翻译后修饰来实现其自发的ER-to-Golgi易位以及相关的潜在机制尚不清楚。因此,破译STING激活的调控机制和靶向活化的STING将为理解自身免疫和开发自身免疫性疾病的潜在治疗策略提供见解。
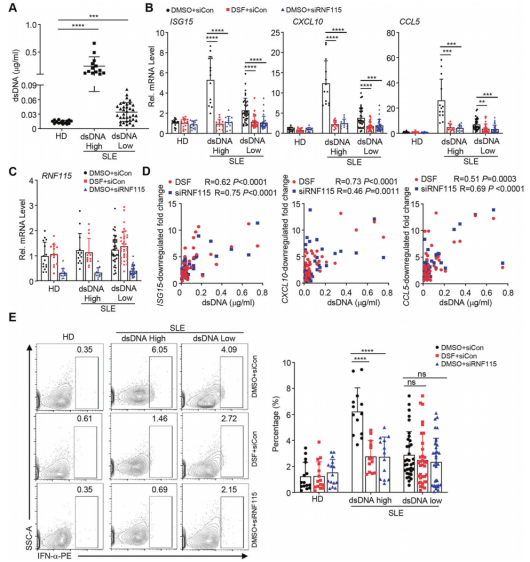
抑制RNF115可下调SLE患者外周血细胞中促炎细胞因子的表达(Credit: Cellular & Molecular Immunology)
RNF115参与乳腺癌、肺腺癌和胃癌的肿瘤发生和恶性细胞的迁移。最近报道,RNF115通过催化RAB1A和RAB13的泛素化并抑制它们与鸟苷二磷酸(GDP)解离抑制剂(GDI)的相互作用来抑制TLRs的再激活,从而负性介导内质网和高尔基体后TLRs的转运。还证明,RNF115通过催化MAVS的泛素化,构成性地破坏MAVS的稳定。相反,RNF115介导STING的k63连锁泛素化,促进其在HSV-1感染后的寡聚、运输和活化。然而,在自发性炎症的情况下,RNF115是否调控STING的活性,以及其潜在的机制仍有待研究。
该研究报道RNF115是一种E3连接酶,在Trex1-/- 细胞和组织中与STING相互作用。RNF115通过催化STING或STINGN153S的k63连锁泛素化来促进STING介导的炎症和自身免疫,该泛素化被RNF115抑制剂双硫醚(DSF)减弱。RNF115的缺失或药理抑制可减弱Trex1-/-小鼠和STINGN153S/WT骨髓嵌合小鼠的自身免疫表型。此外,敲除RNF115或用DSF治疗显著下调外周血dsDNA浓度高的SLE患者外周血PBMCs中IFN-α、IFN-γ和促炎细胞因子的表达。从机制上讲,敲除或抑制RNF115会损害TREX1缺陷小鼠细胞和器官中与K63相关的STING泛素化和寡聚化,并抑制髓细胞中STINGN153S的高尔基定位。该研究结果强调了STING受RNF115调控作为自身免疫性疾病治疗干预靶点的过程。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


