申占龙课题组揭示组蛋白去乙酰化酶指导的胃癌免疫治疗获益人群精准筛选和协同增效新策略
来源:网络 2023-08-25 16:36
胃癌是严重威胁人类健康的常见消化道恶性肿瘤,2020年我国癌症新发病例和死亡病例胃癌均位居第3位。近年来,基于肿瘤微环境(tumor microenvironment, TME)的免疫检查点(PD-1
胃癌是严重威胁人类健康的常见消化道恶性肿瘤,2020年我国癌症新发病例和死亡病例胃癌均位居第3位。近年来,基于肿瘤微环境(tumor microenvironment, TME)的免疫检查点(PD-1/PD-L1)抑制剂在改善胃癌患者预后方面体现出前景,但不同个体疗效差异大,而且缺少理想的疗效预测指标。微卫星高度不稳(MSI-H)患者的肿瘤具有更高的免疫原性,更适合免疫检查点抑制剂治疗,但单药治疗的客观缓解率仅约40%;EB病毒感染患者常伴有大量细胞毒性T细胞浸润,但其多数呈微卫星稳定状态(MSS);基于病理切片的CPS评分也常用于预测胃癌免疫治疗疗效,但评判具有一定的主观性和局限性。因此,亟需寻找更为有效的定量指标评估胃癌TME状态,准确筛选免疫检查点抑制剂获益人群,探索提升免疫检查点抑制剂疗效的新策略。
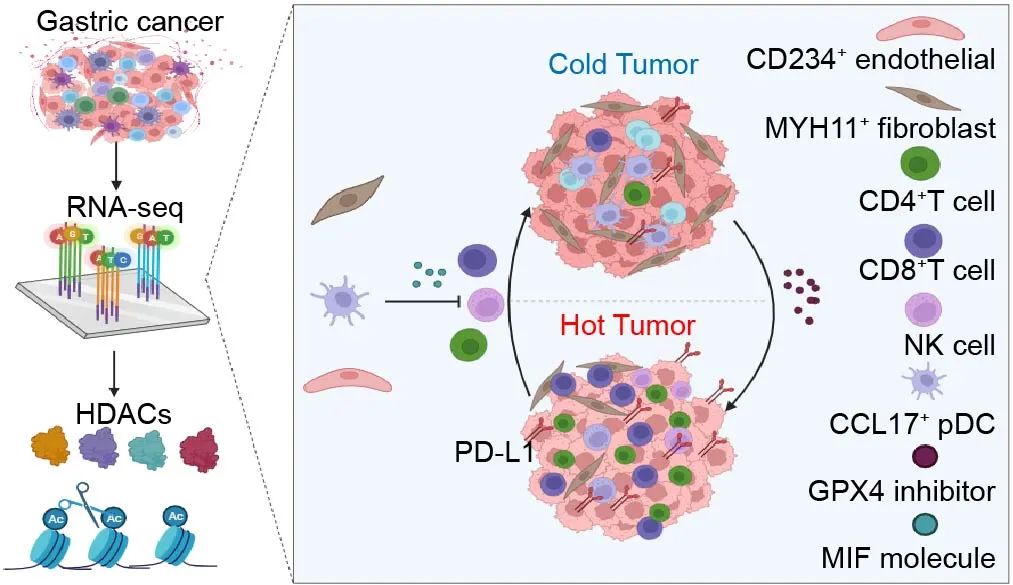
近日,北京大学人民医院胃肠外科申占龙教授课题组在Theranostics上发表了题为Histone deacetylase-mediated tumor microenvironment characteristics and synergistic immunotherapy in gastric cancer的研究论文。研究团队发现胃癌组织中组蛋白去乙酰化酶(Histone deacetylase,HDACs)广泛参与调控肿瘤微环境中免疫细胞浸润水平,并首次利用HDACs表达模式建立了HDS评分模型,能够有效区分胃癌肿瘤微环境“冷”、“热”肿瘤。为了探究相关机理,研究团队通过单细胞转录组分析等发现低HDS胃癌患者的肿瘤微环境中成纤维细胞和内皮细胞比例显著高于高HDS,靶向抑制免疫细胞互作通路中的MIF分子可重塑肿瘤微环境和抑制肿瘤生长。然而,肿瘤细胞本身的异质性也是影响肿瘤微环境的关键因素,研究团队通过纯化肿瘤组织中的肿瘤细胞,利用药物敏感性预测等发现铁死亡诱导剂-GPX4抑制剂对低HDS患者更为敏感,敲低肿瘤细胞GPX4的表达可使肿瘤从低HDS转变为高HDS状态,并显著增强CD8+T细胞浸润和杀伤毒性。该研究为免疫检查点抑制剂治疗获益患者的精准筛选和开发联合治疗新策略提供了重要科学依据。

组蛋白的乙酰化有利于DNA与组蛋白八聚体的解离和核小体结构松弛,从而使各种转录因子和协同转录因子能与DNA结合位点特异性结合激活基因的转录,而组蛋白的去乙酰化则发挥相反的作用。组蛋白去乙酰化酶共分为四类(HDAC Ⅰ,HDAC Ⅱ,HDAC Ⅲ,HDAC Ⅳ),但在胃癌中参与的肿瘤信号调控和微环境细胞浸润水平显著异质性。因此,靶向调控单一的HDAC靶点无法准确调整肿瘤细胞传导及免疫细胞浸润水平。
为解决以上问题,研究团队基于HDACs表达水平通过聚类鉴定出三种胃癌亚型,通过差异基因表达、NMF聚类以及PCA评分方法构建了胃癌量化HDACs亚型的评分模式(HDS),进一步分析发现对免疫检查点抑制剂治疗响应好的胃癌患者的HDS评分显著高于未响应的患者,HDS评分联合传统评价指标(MSI状态和CPS评分)能够显著提升胃癌对免疫检查点抑制剂疗效的预测效能(AUC=0.96)。
研究团队通过对临床队列转录组和多重免疫荧光分析发现:高HDS评分患者具有更好的生存预后;MSI-H和EB病毒阳性患者的HDS表达水平最高,且HDS与T细胞、NK细胞浸润水平显著正相关,与M2型巨噬细胞和MDSC细胞浸润水平显著负相关,提示HDS评分能够有效的评估胃癌肿瘤微环境中免疫细胞浸润水平,并解释了EB病毒感染患者呈现MSS特征但免疫浸润程度高的原因。
为了进一步探究导致不同HDS患者肿瘤微环境差异的原因,研究团队利用单细胞转录组数据分析发现,在低HDS患者中,MYH11+成纤维细胞和CD234+内皮细胞与T细胞、NK细胞的通讯频率显著高于高HDS患者,低HDS患者的成纤维细胞和内皮细胞高表达MIF,通过MIF-CD74信号通路抑制T细胞和NK细胞浸润。小鼠皮下种植瘤实验显示,抑制MIF可以显著抑制肿瘤生长和促进瘤内CD8+T细胞和CD4+T的浸润水平。
肿瘤细胞的异质性也是影响肿瘤微环境的重要因素。研究团队采用生物信息学方法删除肿瘤组织中微环境成分,纯化肿瘤组织,通过药物敏感性预测分析发现铁死亡诱导剂—GPX4抑制剂对低HDS肿瘤更为敏感。进一步研究显示:敲低胃癌细胞GPX4表达可使胃癌组织从低HDS转变为高HDS状态,显著增强CD8+T细胞浸润和杀伤毒性,而且抑制GPX4表达与PD-L1抑制剂联用的治疗效果明显优于PD-L1单药治疗。该结果说明GPX4抑制剂可能重塑胃癌HDS状态,使其更有利于免疫检查点抑制剂发挥作用。
综上所述,研究团队基于HDACs表达模式构建了评价胃癌肿瘤微环境的新指标-HDS,有助于精准筛选适合免疫检查点抑制剂治疗的人群,同时揭示了逆转胃癌“冷”肿瘤转变为“热”肿瘤的潜在靶点,为制定免疫检查点抑制剂的联合增效新策略提供了重要指导。
北京大学人民医院胃肠外科申占龙教授为该论文通讯作者,北京大学人民医院胃肠外科林易霖博士、荆翔湘博士、福建医科大学附属第一医院陈志华博士、潘晓娴博士为该论文共同第一作者。
原文链接:
https://www.thno.org/v13p4574.htm
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


