JEM:好睡眠,养造血干细胞!科学家发现,碎片化睡眠会改变造血干/祖细胞的表观遗传修饰,加剧炎症反应,加速遗传漂变
来源:奇点糕 2022-10-20 09:04
本研究揭示了睡眠不足对造血功能和免疫系统产生长远影响的内在机制。
所有熬过的夜,你的身体会替你记住。
据统计,超过一半的成年人存在睡眠不足的情况[1],而睡眠不足会对人体产生广泛而深远的影响,即使在熬夜之后进行补觉,也无法完全抵消对身体的不良影响[2]。
就拿睡眠和免疫来说,睡眠可影响免疫系统的许多方面,如适应性反应、炎症反应以及细胞因子和免疫介质的合成等,充足的睡眠可预防诸如癌症、心血管疾病、神经退行性疾病等与免疫息息相关的疾病[3]。然而,目前对于睡眠影响免疫功能和疾病易感性的机制知之甚少。
近日,来自西奈山伊坎医学院的Filip K. Swirski和Cameron S. McAlpine团队以及哥伦比亚大学的Marie-Pierre St-Onge团队在《实验医学杂志》发表重磅研究,揭示了碎片化睡眠(SF)通过影响造血干/组细胞的表观遗传修饰,从而对免疫反应产生长远影响的内在机制[4]。
研究人员发现,SF改变了小鼠骨髓造血干/组细胞的表观遗传修饰,从而促进其增殖和向髓系(与淋巴系相对,包括单核细胞、粒细胞、红细胞和血小板)分化,加剧了机体对炎症的反应。同时,造血干/组细胞的扩增还加速了遗传漂变,减少了造血克隆的多样性。
此外,研究人员还证明了在人类中,睡眠同样起到调控造血功能、重塑造血干/组细胞表观遗传修饰的作用。

论文首页截图
科学家们之前就曾发现,睡眠质量差和睡眠障碍的人群血液中髓系细胞的数目增加[5],且充足的睡眠可减少动脉粥样硬化人群血液中单核细胞和中性粒细胞的数量,抑制白细胞向动脉壁渗透,从而缩小动脉粥样硬化病变面积[6]。然而,其内在的机制并不明确。
为了探索睡眠影响造血与免疫功能的机制,研究人员首先对小鼠进行了SF干预,即在小鼠休息周期每隔2分钟唤醒小鼠,为期16周,并对小鼠的血液和骨髓进行了相关检测。
果不其然,16周的SF增加了骨髓中LSK细胞(造血干细胞)的增殖,增加了髓系集落刺激因子(M-CSF)的浓度;在血液中,SF干预导致休息周期Ly6Chi单核细胞数量增加,IL-6水平升高,而其他细胞因子和皮质酮则未有明显改变。
紧接着,研究人员继续监测了SF小鼠10周,在这10周内,小鼠的睡眠不受打扰。在恢复无干扰睡眠(RS)的前两周,小鼠在睡眠时觉醒次数仍然较高(没缓过来),在随后的8周小鼠的睡眠恢复到基线水平。
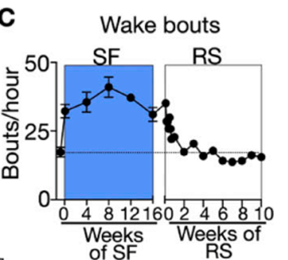
小鼠在RS 2周后睡眠时的觉醒次数恢复到基线水平
在RS 4周后,与对照组小鼠相比,经历过SF的小鼠血液中Ly6Chi单核细胞、骨髓中LSK细胞数目仍然更高,到RS 10周时,经历过SF的小鼠的造血功能才降低到对照组水平。
研究人员还将SF小鼠(CD45.2+)和对照组小鼠(CD45.1+)的LSK细胞按1:1的比例移植到受辐照抑制自身骨髓造血功能的表达绿色荧光蛋白(GFP)小鼠体内(GFP小鼠正常睡眠)。
在移植3周后,来自SF小鼠的LSK细胞(GFP-CD45.2+)增殖明显更多;移植24周后,来自SF小鼠的白细胞和单核细胞占到血液中白细胞和单核细胞数目的60%以上。
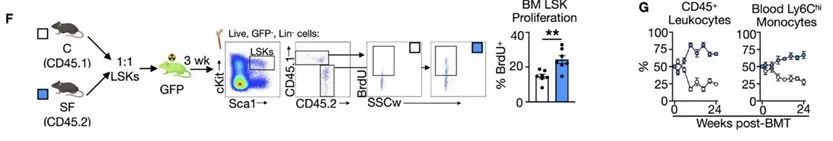
SF小鼠的LSK细胞增殖能力增强
因此,SF可以长远地影响骨髓造血功能,尤其是增加血液中的白细胞数目。
那么SF是如何影响骨髓造血功能的呢?
为了研究这一问题,研究人员对骨髓中造血干/祖细胞的表观基因组学进行了分析,发现SF小鼠HSPC中组蛋白脱乙酰酶(HDAC)活性增加。染色质转座酶可及性测序(ATAC-seq)结果则显示,相比于对照组小鼠,SF组小鼠LSK细胞中有470个增强子存在可及性差异(与对照组相比,65个获得可及性,405个失去可及性),表明SF影响了LSK细胞的表观遗传修饰。
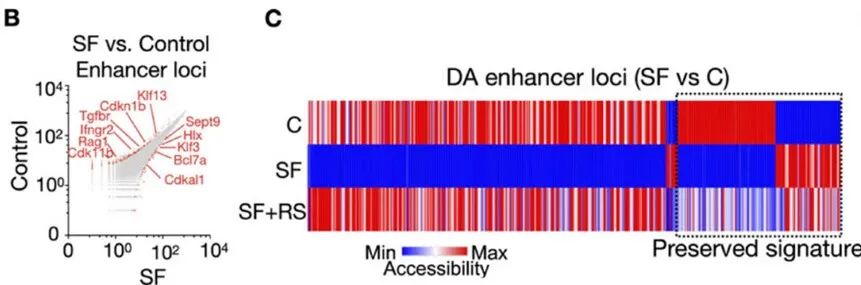
SF影响了LSK细胞的表观遗传修饰
此外,SF后恢复RS 10周后,69%由SF引起的增强子可及性变化恢复到对照水平,31%(140)的增强子可及性变化依旧明显。这再次表明了即使在恢复良好睡眠后,SF对造血系统仍存在长远影响。
进一步的分析表明,SF使得LSK细胞向淋巴系分化的增强子(如Bcl11a、Ftl3、Sox4、Icos、Il15、Rag1、Pax5、Ets1和Btk)可及性减弱,向髓系分化的增强子(如Csf2rb、Irf2bp2、Dyrk3、Erg、Klf9和Klf3)可及性增强。且在RS 10周后,许多髓系分化增强子可及性的改变仍然存在。
这一发现明确了SF使得血液中髓系细胞增多的原因,即SF改变了LSK细胞向髓系分化基因的表观遗传修饰。
更为重要的是,这种SF对造血干细胞表观遗传修饰的影响加剧了小鼠对炎症的反应。
将对照组小鼠和经历16周SF-10周RS小鼠进行盲肠结扎和穿孔(脓毒血症动物模型)24小时后,16周SF-10周RS小鼠的炎症反应更为剧烈,其血液单核细胞和骨髓LSK数目增加,血液IL-6和TNF-α水平增加。这种剧烈的炎症反应使得小鼠病情加重,存活率降低。
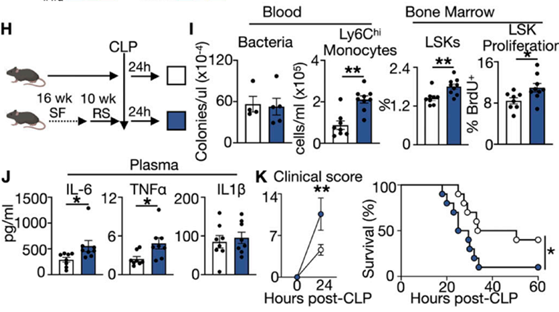
SF对造血干/祖细胞表观遗传修饰的影响加剧了小鼠对炎症的反应
这些结果表明,SF通过对造血干/祖细胞表观遗传的重编程,改变其分化倾向,并加剧了对炎症的反应。
由于SF对LSK细胞分化和增殖均有影响,可能对LSK细胞群体的体细胞进化产生影响。造血克隆的扩张和均质化是一种常见的与年龄相关的癌前状态,称为克隆性造血作用(CH),可由体细胞突变的累积驱动(如表观遗传修饰蛋白Tet2和Dmnt3a)[7]。然而,大多数CH病例发生在没有可检测到的驱动突变的情况下[8]。
通过多色LSK细胞克隆跟踪系统,研究人员证实了SF引起的LSK细胞倾向髓系分化和增殖增加,导致一些细胞集群扩增和另一些细胞集群消失,即加速了遗传漂变。而对照组小鼠LSK细胞遗传漂变的速度明显更慢,表明良好的睡眠可维持骨髓造血干/祖细胞的克隆性多样性。
最后,研究人员在人类中进行了研究,对睡眠正常的年轻进行慢性轻度睡眠不足干预(6周正常睡眠,每晚睡眠时间平均为7.4±0.1小时;6周睡眠不足,每晚睡眠时间平均为6.1±0.1小时)。
试验结果表明,在睡眠不足阶段,人体晚上的单核细胞数明显更多,而在白天并未观察到单核细胞数的变化。此外,睡眠不足同样增强了骨髓的造血功能,并改变了造血干/祖细胞的表观遗传修饰,表现为组蛋白乙酰转移酶(HAT)和HDAC活性增强,由此减少了组蛋白H3的乙酰化。
这些结果表明了睡眠在人类中同样起到调节造血功能、重塑造血干/祖细胞表观遗传修饰的作用。
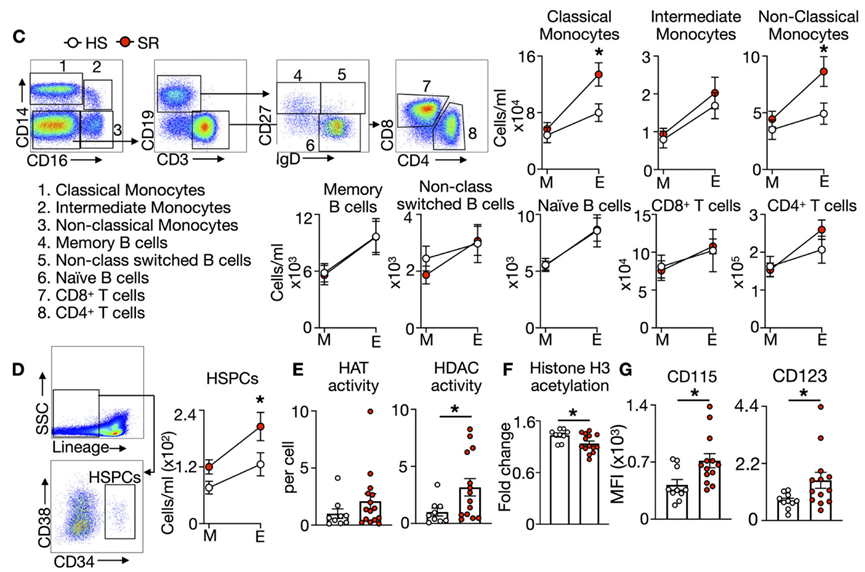
睡眠在人类中同样起到调节造血功能、重塑造血干/祖细胞表观遗传修饰的作用
总的来说,本研究揭示了睡眠不足对造血功能和免疫系统产生长远影响的内在机制。
在人类与小鼠中,睡眠不足均可使得骨髓造血干/祖细胞增殖增加,并倾向于向髓系分化,降低了克隆多样性并加剧了机体对炎症的反应,这背后内在的机制则是造血干/祖细胞表观遗传修饰的变化。
所以,珍惜睡觉的每一分每一秒,你的每一个造血干/祖细胞都会感谢你。
参考文献
1. Ford ES, Cunningham TJ, Croft JB: Trends in Self-Reported Sleep Duration among US Adults from 1985 to 2012. Sleep 2015, 38(5):829-832.
2. Depner CM, Melanson EL, Eckel RH, Snell-Bergeon JK, Perreault L, Bergman BC, Higgins JA, Guerin MK, Stothard ER, Morton SJ et al: Ad libitum Weekend Recovery Sleep Fails to Prevent Metabolic Dysregulation during a Repeating Pattern of Insufficient Sleep and Weekend Recovery Sleep. Curr Biol 2019, 29(6):957-967 e954.
3. Irwin MR: Sleep and inflammation: partners in sickness and in health. Nat Rev Immunol 2019, 19(11):702-715.
4. McAlpine CS, Kiss MG, Zuraikat FM, Cheek D, Schiroli G, Amatullah H, Huynh P, Bhatti MZ, Wong LP, Yates AG et al: Sleep exerts lasting effects on hematopoietic stem cell function and diversity. J Exp Med 2022, 219(11).
5. Ruiz FS, Andersen ML, Martins RC, Zager A, Lopes JD, Tufik S: Immune alterations after selective rapid eye movement or total sleep deprivation in healthy male volunteers. Innate Immun 2012, 18(1):44-54.
6. Vallat R, Shah VD, Redline S, Attia P, Walker MP: Broken sleep predicts hardened blood vessels. PLoS Biol 2020, 18(6):e3000726.
7. Jaiswal S, Fontanillas P, Flannick J, Manning A, Grauman PV, Mar BG, Lindsley RC, Mermel CH, Burtt N, Chavez A et al: Age-related clonal hematopoiesis associated with adverse outcomes. N Engl J Med 2014, 371(26):2488-2498.
8. Mitchell E, Spencer Chapman M, Williams N, Dawson KJ, Mende N, Calderbank EF, Jung H, Mitchell T, Coorens THH, Spencer DH et al: Clonal dynamics of haematopoiesis across the human lifespan. Nature 2022, 606(7913):343-350. ADtaxi
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


